
【题目】改变0.1 mol·L-1己二酸(简写为H2A,电离常数分别为Ka1、Ka2)溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示。下列叙述错误的是

A.Ka1=10-4.4
B.曲线II表示的是HA-的物质的最分数δ(X)肋pH的变化关系
C.NaHA溶液中:c(H+)=c(OH-)+2c(A2-)-c(H2A)
D.等物质的量浓度的Na2A与NaHA混合溶液中:c(Na+)>c(A2-)>c(HA-)>c(H+)>c(OH-)
科目:高中化学 来源: 题型:
【题目】25℃时,在等体积的①pH=0的H2SO4溶液,②0.05 mol/L的Ba(OH)2溶液③pH=10的Na2S溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是
A.![]() B.
B.![]()
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍,B在D的单质中充分燃烧能生成其最高价化合物BD2,E+与D2-具有相同的电子数。A在F是单质中燃烧,产物溶于水得到一种强酸。下列有关说法正确的是( )
A.工业上F单质用MnO2和AF来制备
B.B元素所形成的单质的晶体类型都是相同的
C.F所形成的氢化物的酸性强于BD2的水化物的酸性,说明F的非金属性强于B
D.由化学键角度推断,能形成BDF2这种化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应2A ![]() B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
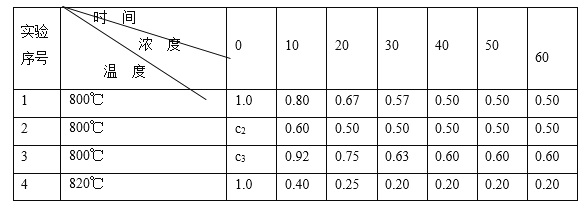
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为_____mol/(L·min)。
(2)在实验2,A的初始浓度c2=____________mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是___________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3_______v1(填>、=、<),且c3_______1.0 mol/L(填>、=、<)。
(4)比较实验4和实验1,可推测该反应是____反应(选填吸热、放热)。理由是 __________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列水解反应的离子方程式书写正确的是
A.Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B.Cl+H2O![]() HCl+OH
HCl+OH
C.CO32-+2H2O![]() H2CO3+2OH
H2CO3+2OH
D.NH4++2H2O![]() NH3·H2O+H3O+
NH3·H2O+H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁在史前就为人们所知,由于铁、钴、镍性质很相似故称为铁系元素。回答下列问题:
(1)铁、钴、镍中未成对电子数目最多的为_____,镍的外围电子轨道表达式为_____。
(2)Co2+可以和SCN-作用形成蓝色配离子,该反应可用于Co2+的定性检验。
①SCN-的空间构型为____,组成元素中第一电离能最大的是___。
②SCN-对应的酸有硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S),这两种酸中后者沸点较高,主要原因是_________________。
(3)二茂铁是一种夹心式结构的配合物,通常认为是由一个Fe2+离子和两个C5H5-离子形成的,X射线研究结果指出两个C5H5-环的平面是平行的,结构如图1所示。C5H5-中碳原子的杂化类型为_____。分子中的大π键盘可用符号![]() 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键盘电子数,则C5H5-中的大π键盘可以表示为______。
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键盘电子数,则C5H5-中的大π键盘可以表示为______。
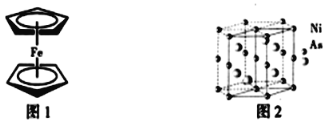
(4)NiAs晶体中的原子堆积方式如图2所示,其中As的配位数为______。六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,NiAs的密度为______g·cm-3,(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.氯化铝溶液与一定量的碳酸钠溶液反应:Al3++3CO32-+3H2O=Al(OH)3↓+3HCO3-
B.氯化钠固体与浓硫酸混合微热:Cl-+H+![]() HCl↑
HCl↑
C.氯气通入石灰乳:Cl2+2OH-=Cl-+ClO-+H2O
D.苯酚钠溶液呈碱性的原理:C6H5O-+H2O→C6H5OH+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气可直接用于自来水的消毒,也可以制取漂粉精、高铁酸钠等物质来对自来水消毒。
(1)氯气通入水中可用来杀菌消毒,其中杀菌消毒的原理是___,其有效成分的电子式是____。
(2)氯气可用来制取漂粉精,但干燥的氢氧化钙与氯气并不易发生反应,氯气只能被氢氧化钙所吸附。为此,在工业上采用加入少许水的消石灰来进行氯化。其原因是____;
(3)漂粉精的消毒能力受水的pH影响,pH较小时的消毒能力____(填“大于”或“小于”) ;pH大时的消毒能力,其原因是______。
(4)用氯气对饮用水消毒副作用多,产生影响人体健康有机氯衍生物。可用氯气制取高铁酸钠净水:___Fe3++____ (__________) + ___Cl2→___FeO42-+____ +___H2O
补全缺项,并配平上述离子方程式;
(5)计算Na2FeO4的消毒效率(以单位质量得到的电子数表示)约是氯气____倍。说明该净水剂与氯气相比较有何优越性 _______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中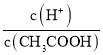 减小
减小
B.CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C.向0.1 mol·L-1氨水中加入少量硫酸铵固体,溶液中![]() 增大
增大
D.向AgCl、AgBr的饱和溶液中加入少量硝酸银,溶液中![]() 不变
不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com