
【题目】下列水解反应的离子方程式书写正确的是
A.Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B.Cl+H2O![]() HCl+OH
HCl+OH
C.CO32-+2H2O![]() H2CO3+2OH
H2CO3+2OH
D.NH4++2H2O![]() NH3·H2O+H3O+
NH3·H2O+H3O+
科目:高中化学 来源: 题型:
【题目】25℃时,向体积为 10 mL 的 0.1 mol/LNaOH溶液中逐滴加入0.1mol/LCH3COOH溶液,曲线如图所示。下列有关离子浓度关系的比较中,错误的是
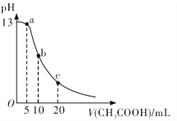
A. a点处:c( Na+)>c(CH3COO-)>c(OH-)>c(H+)
B. b点处:c(CH3COOH)+c(H+ )=c(OH-)
C. c点处:c(CH3COOH)+c(CH3COO-)=2c(Na+)
D. NaOH溶液和CH3COOH溶液以任意比混合时:c( Na+)+c(H+)=c(OH-)+(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中发生如下反应:A(g)+3B(g)![]() 2C(g) ΔH<0,根据下列速率—时间图像,回答下列问题。
2C(g) ΔH<0,根据下列速率—时间图像,回答下列问题。
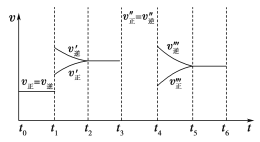
(1)下列时刻所改变的外界条件是:
t1________;t3________;t4________;
(2)物质A的体积分数最大的时间段是________________;
(3)上述图像中C的体积分数相等的时间段是________________;
(4)反应速率最大的时间段是________________。
(5)t0~t1、t3~t4、t5~t6时间段的平衡常数K0、K3、K5的关系________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究以芒硝Na2SO4·10H2O和CaO为原料制备Na2CO3。
(1)将CaO水化后,与芒硝形成Na2SO4-Ca(OH)2-H2O三元体系,反应后过滤,向滤液中通入CO2,期望得到Na2CO3。三元体系中反应的离子方程式为: SO42-+ Ca(OH)2(s)+2H2O![]() CaSO4·2H2O(s)+2 OH-
CaSO4·2H2O(s)+2 OH-
该反应的平衡常数表达式K=_________________________。
往Na2SO4-Ca(OH)2-H2O三元体系中添加适量的某种酸性物质,控制pH=12.3 [即c(OH-)=0.02mol/L],可使反应在常温下容易进行。反应后过滤,再向滤液中通入CO2,进一步处理得到Na2CO3。
(2)在Na2SO4-Ca(OH)2-H2O三元体系中不直接通入CO2,其理由是_______________________________________________________________。
(3)添加的酸性物质须满足的条件(写出两点)是_____________、______________。
(4)用平衡移动原理解释添加酸性物质的理由:____________________________________;以HA表示所添加的物质,则总反应的离子方程式可写为_______________________。
(5)Na2CO3溶液中存在水解平衡:CO32-+H2O![]() HCO3-+OH-。下列说法错误的是_________。
HCO3-+OH-。下列说法错误的是_________。
a.加水稀释,溶液中所有离子的浓度都减小
b.通入CO2,溶液pH减小
c.加入NaOH固体,![]() 减小
减小
d.稀释溶液,平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水的电离平衡中,c(H+)和c(OH)的关系如图所示:
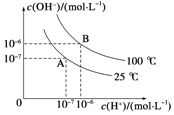
(1)A点水的离子积为1×1014mol2/L2,B点水的离子积为_______.造成水的离子积变化的原因是________。
(2)100℃时,若向溶液中滴加盐酸,能否使体系处于B点位置?为什么?_______ ; ______.
(3)100℃时,若盐酸中c(H+)=5×104mol/L,则由水电离产生的c(H+)是________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.1 mol·L-1己二酸(简写为H2A,电离常数分别为Ka1、Ka2)溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示。下列叙述错误的是

A.Ka1=10-4.4
B.曲线II表示的是HA-的物质的最分数δ(X)肋pH的变化关系
C.NaHA溶液中:c(H+)=c(OH-)+2c(A2-)-c(H2A)
D.等物质的量浓度的Na2A与NaHA混合溶液中:c(Na+)>c(A2-)>c(HA-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吗氯贝胺是一种治疗抑郁症的药物,其中一种合成路线及相关转化如图所示:
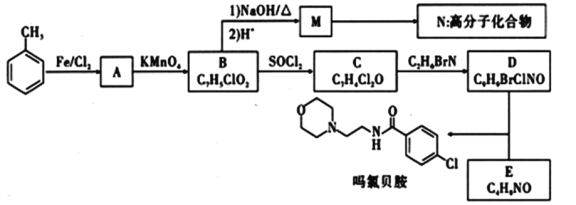
已知信息:①、![]()
②![]() +HCl
+HCl
(1)B的名称_____。
(2)C的结构简式______;A到B的反应类型为______;D中含氧官能团的名称_____。
(3)请写出形成N高分子化合物的方程式________。
(4)写出由D和E反应生成吗氯贝胺的方程式_______。
(5)物质I比C的相对原子质量大14,符合下列条件I的同分异构体有__种。
①能发生银镜反应 ②苯环上有三个取代基
(6)结合以上合成路线信息,设计以CH3-![]() -CH3和CH3-CH2-NH2为原料(无机试剂任选),合成有机物
-CH3和CH3-CH2-NH2为原料(无机试剂任选),合成有机物![]() 的合成路线______。
的合成路线______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结晶硫酸亚铁部分失水时,分析结果如仍按FeSO4·7H2O的质量分数计算,其值会超过100%。国家标准规定,FeSO4·7H2O的含量:一级品99.50%~100.5%;二级品99.00%~100.5%;三级品98.00%~101.0%。
为测定样品中FeSO4·7H2O的质量分数,可采用在酸性条件下与高锰酸钾溶液进行滴定。
5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O;
2MnO4-+5C2O42-+16H+→2Mn2++10CO2↑+8H2O
测定过程:粗配一定浓度的高锰酸钾溶液1L,然后称取0.200 g 固体Na2C2O4(式量为134.0)放入锥形瓶中,用蒸馏水溶解并加稀硫酸酸化,加热至70℃~80℃。
(1)若要用滴定法测定所配的高锰酸钾溶液浓度,滴定终点的现象是_______________。
(2)将溶液加热的目的是____;反应刚开始时反应速率较小,其后因非温度因素影响而增大,根据影响化学反应速率的条件分析,其原因可能是______________________。
(3)若滴定时发现滴定管尖嘴部分有气泡,滴定结束气泡消失,则测得高锰酸钾浓度_____(填“偏大”“偏小”“无影响”)。
(4)滴定用去高锰酸钾溶液29.50mL,则c(KMnO4)=_____mol/L(保留四位有效数字)。
(5)称取四份FeSO4·7H2O试样,质量均为0.506g,,用上述高锰酸钾溶液滴定达到终点,记录滴定数据
滴定次数 实验数据 | 1 | 2 | 3 | 4 |
V(高锰酸钾)/mL(初读数) | 0.10 | 0.20 | 0.00 | 0.20 |
V(高锰酸钾)/mL(终读数) | 17.76 | 17.88 | 18.16 | 17.90 |
该试样中FeSO4·7H2O的含量(质量分数)为_________(小数点后保留两位),符合国家______级标准。
(6)如实际准确值为99.80%,实验绝对误差=____%,如操作中并无试剂、读数与终点判断的失误,则引起误差的可能原因是:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是反应CO(g)+2H2(g) = CH3OH(g)进行过程中的能量变化曲线。下列相关说法正确的是

A. 该反应是吸热反应
B. 使用催化剂后反应热减小
C. 热化学方程式为CO(g)+2H2(g) = CH3OH(g)△H=-510 kJ·mol-1
D. 曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com