
【题目】某化学反应2A ![]() B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
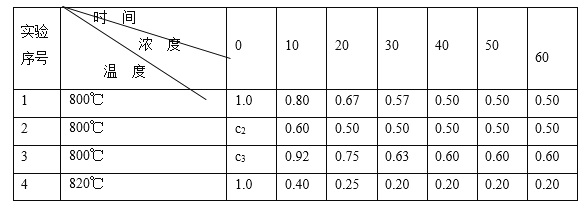
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为_____mol/(L·min)。
(2)在实验2,A的初始浓度c2=____________mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是___________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3_______v1(填>、=、<),且c3_______1.0 mol/L(填>、=、<)。
(4)比较实验4和实验1,可推测该反应是____反应(选填吸热、放热)。理由是 __________
【答案】0.013 1.0 催化剂 > > 吸热 温度升高时,平衡向右移动
【解析】
(1)根据v=![]() 公式解题;
公式解题;
(2)实验1和实验2达到平衡时A的浓度不再改变且相等,说明实验2与实验1其他条件完全相同,实验2使用了催化剂,加快了反应速率,缩短了达平衡的时间;
(3)以10至20min为例求出实验1和实验3的反应速率进行比较;
(4)根据化学平衡移动原理分析,加热平衡向吸热反应方向移动。
(1)在实验1中,反应在10至20min时间内平均速率为v=![]() =
=![]() =0.013 mol/(L·min),故答案为:0.013;
=0.013 mol/(L·min),故答案为:0.013;
(2)实验1和实验2达到平衡时A的浓度不再改变且相等,说明实验2与实验1其他条件完全相同,实验1与实验2中A的初始浓度应相等,起始浓度c2=1.0mol/L,实验2较其他实验达到平衡时间最短,是使用了合适的催化剂,
故答案为:1.0;催化剂;
(3)在实验1中,反应在10至20min时间内平均速率为v=![]() =
=![]() =0.013 mol/(L·min),在实验3中,反应在10至20min时间内平均速率为v=
=0.013 mol/(L·min),在实验3中,反应在10至20min时间内平均速率为v=![]() =
=![]() =0.015 mol/(L·min),故v3>v1,实验1的起始浓度为1.0mol/L,由平衡时浓度可知在实验3的起始浓度大于1.0mol/L,即c3>1.0 mol/L,故答案为:>;>;
=0.015 mol/(L·min),故v3>v1,实验1的起始浓度为1.0mol/L,由平衡时浓度可知在实验3的起始浓度大于1.0mol/L,即c3>1.0 mol/L,故答案为:>;>;
(4)比较实验4和实验1可知平衡时实验4反应物A的浓度小,由实验1到实验4升高温度,平衡右移,加热平衡向吸热反应方向移动;
故答案为:吸热;温度升高时,平衡向右移动。


 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
【题目】在下列各溶液中,离子一定能大量共存的是( )
A.pH=1的溶液中:HCO3﹣、NH4+、NO3﹣、Ca2+
B.在强碱性溶液中:Na+、K+、AlO 2﹣、Cl﹣
C.无色溶液中:Fe3+、MnO4﹣、Cl﹣、H+
D.由水电离的c(H+)=1.0×10﹣12 molL﹣1的溶液中:ClO﹣、Na+、![]() 、K+
、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 盐酸普罗帕酮是一种高效速效抗心律失常药。合成此药的原料D的流程如下:
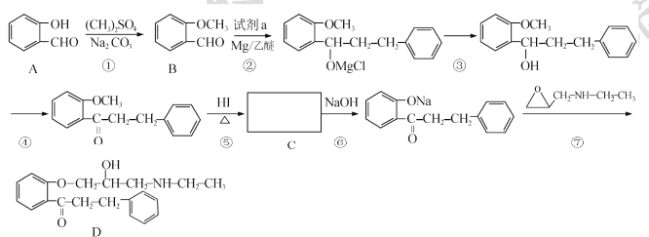
已知: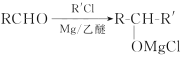
请回答以下问题:
(I)A的化学名称为____,试剂a的结构简式为____。
(2)C的官能团名称为____________。
(3)反应⑤的反应类型为____;反应①和⑤的目的为_______。
(4)满足下列条件的B的同分异构体还有 ___种(不包含B)。其中某同分异构体x能发生水解反应,核磁共振氢谱有4组峰且峰面积比为3:2:2:1,请写出x与NaOH溶液加热反应的化学方程式____。
①能发生银镜反应 ②苯环上有2个取代基
(5)关于物质D的说法,不正确的是____(填标号)。
a.属于芳香族化合物
b.易溶于水
c.有三种官能团
d.可发生取代、加成、氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量浓度相同的200mLBa(OH)2溶液和150mLNaHCO3混合后,最终溶液中离子的物质的量浓度关系正确的是( )
A.c(OH-)>c(Ba2+)>c(Na+)>c(CO32-)B.c(OH-)>c(Na+)>c(Ba2+)>c(H+)
C.c(OH-)=c(Ba2+)+c(Na+)+c(H+)D.c(H+)+c(Na+)+c(Ba2+)=c(OH-)+c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究以芒硝Na2SO4·10H2O和CaO为原料制备Na2CO3。
(1)将CaO水化后,与芒硝形成Na2SO4-Ca(OH)2-H2O三元体系,反应后过滤,向滤液中通入CO2,期望得到Na2CO3。三元体系中反应的离子方程式为: SO42-+ Ca(OH)2(s)+2H2O![]() CaSO4·2H2O(s)+2 OH-
CaSO4·2H2O(s)+2 OH-
该反应的平衡常数表达式K=_________________________。
往Na2SO4-Ca(OH)2-H2O三元体系中添加适量的某种酸性物质,控制pH=12.3 [即c(OH-)=0.02mol/L],可使反应在常温下容易进行。反应后过滤,再向滤液中通入CO2,进一步处理得到Na2CO3。
(2)在Na2SO4-Ca(OH)2-H2O三元体系中不直接通入CO2,其理由是_______________________________________________________________。
(3)添加的酸性物质须满足的条件(写出两点)是_____________、______________。
(4)用平衡移动原理解释添加酸性物质的理由:____________________________________;以HA表示所添加的物质,则总反应的离子方程式可写为_______________________。
(5)Na2CO3溶液中存在水解平衡:CO32-+H2O![]() HCO3-+OH-。下列说法错误的是_________。
HCO3-+OH-。下列说法错误的是_________。
a.加水稀释,溶液中所有离子的浓度都减小
b.通入CO2,溶液pH减小
c.加入NaOH固体,![]() 减小
减小
d.稀释溶液,平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)![]()
![]() N2(g)+CO2(g);ΔH=-373.2 kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
N2(g)+CO2(g);ΔH=-373.2 kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
A.加催化剂同时升高温度B.加催化剂同时增大压强
C.升高温度同时充入N2D.降低温度同时增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.1 mol·L-1己二酸(简写为H2A,电离常数分别为Ka1、Ka2)溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示。下列叙述错误的是

A.Ka1=10-4.4
B.曲线II表示的是HA-的物质的最分数δ(X)肋pH的变化关系
C.NaHA溶液中:c(H+)=c(OH-)+2c(A2-)-c(H2A)
D.等物质的量浓度的Na2A与NaHA混合溶液中:c(Na+)>c(A2-)>c(HA-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电渗析法是指在外加电场作用下,利用阴离子交换膜和阳离子交换膜的选择透过性,使部分离子透过离子交换膜而迁移到另一部分水中,从而使一部分水淡化而另一部分水浓缩的过程。下图是利用电渗析法从海水中获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为石墨电极。

下列有关描述错误的是
A.阳离子交换膜是A,不是B
B.通电后阳极区的电极反应式:2Cl--2e-→Cl2↑
C.工业上阴极使用铁丝网代替石墨碳棒,以减少石墨的损耗
D.阴极区的现象是电极上产生无色气体,溶液中出现少量白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一种天然除草剂的结构,下列说法正确的是
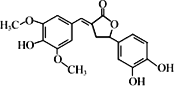
A.该除草剂可以和NaHCO3溶液发生反应
B.该除草剂分子中所有碳原子一定在同一平面内
C.1 mol该除草剂最多能与6 mol NaOH反应
D.该除草剂与足量的H2加成反应的产物含7个手性碳原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com