
【题目】下列关于各图的叙述正确的是
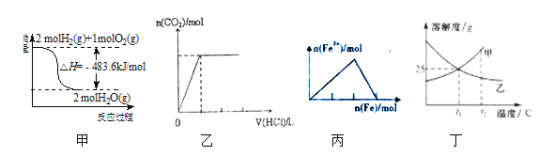
A.甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8kJmol-1
B.乙表示向碳酸钠溶液中逐滴滴加稀盐酸,生成CO2与所加盐酸的物质的量的关系
C.丙表示在稀硝酸溶液中加入铁粉,溶液中Fe3+的变化曲线
D.丁表示t1℃时质量分数均为20%的甲、乙两种溶液,升温到t2℃时,两种溶液中溶质的质量分数仍然相等
【答案】C
【解析】
A.图象中2mol氢气完全燃烧生成的是水蒸气时放热241.8kJ,不是氢气的燃烧热,故A错误;
B.Na2CO3+HCl═NaCl+NaHCO3,NaHCO3+HCl═NaCl+H2O+CO2↑,所以开始时没有气体生成,当碳酸钠完全转化为碳酸氢钠时再加入稀盐酸产生二氧化碳,其图象为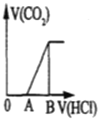 ,故B错误;
,故B错误;
C.在稀硝酸溶液中加入铁粉,最初硝酸过量溶液中只含有Fe3+,硝酸完全反应后,过量的铁将Fe3+还原为Fe2+,反应完全后溶液中的Fe3+的量为0,Fe3+的变化符合曲线丙,故C正确;
D.t1℃时质量分数均为20%的甲、乙两种溶液,溶质质量分数相同,升温到t2℃时,溶液乙中溶质溶解度随温度升高减小会析出晶体,两种溶液中溶质的质量分数不相等,故D错误;
答案为C。


科目:高中化学 来源: 题型:
【题目】如表是A、B、C、D四种常见有机物的相关信息。
有机物A | 有机物B | 有机物C | 有机物D |
①可用于果实催熟 ②比例模型为 | ①由C、H两种元素组成 ②球棍模型为 | ①生活中常见的液态有机物,分子中碳原子数与有机物A相同, ②能与Na反应,但不能与NaOH反应 | ①相对分子质量比有机物C大14 ②能由有机物C氧化生成 |
根据表中信息回答下列问题:
(1)有机物A的分子式为________。
(2)下列有关有机物A、B的说法正确的是________(填字母)。
a.A、B均可使酸性KMnO4溶液褪色
b.A、B分子中所有的原子在同一平面内
c.等质量的A、B完全燃烧,消耗氧气的量相同
d.A、B分子均含有碳碳双键,能发生加成反应
(3)写出有机物C的同分异构体的结构简式:________。
(4)在一定条件下,有机物C与有机物D反应能生成具有水果香味的物质E,其化学反应方程式为_______,某次实验中,以5.0gD为原料,制得4.4gE,则D的转化率为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体化合物X由四种常见的元素组成,为探究其成分,某学生进行如下实验:
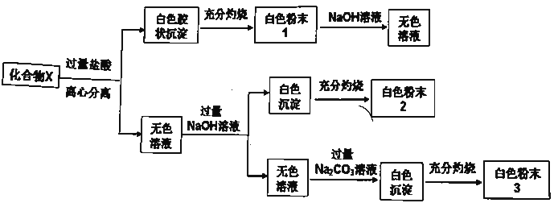
①20.8gX固体进行实验,得到白色粉末1质量12.0g,白色粉末2质量为6.0g;
②白色粉末2可用作耐高温材料,白色粉末3是一种常见干燥剂;请回答问题:
(1)X中金属元素的名称是______。
(2)化合物X与足量盐酸反应离子方程式______。
(3)在高温条件下,白色粉末2中某元素单质与白色粉末1反应,是工业制备另一种单质方法之一,写出该反应的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
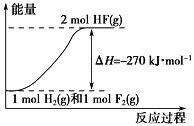
【题目】已知:H2(g)+F2(g) ===2HF(g) ΔH=-270 kJ·mol-1。下列说法正确的是
A. 在相同条件下,1 mol H2(g)与1 mol F2(g)的能量总和小于2 mol HF(g)的能量
B. 1 mol H2(g)与1 mol F2(g)反应生成2 mol液态HF放出的热量大于270 kJ
C. 该反应的逆反应是放热反应
D. 该反应过程的能量变化可用下图来表示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO。其过程如下:
mCeO2![]() (m-x)CeO2·xCe+xO2(m-x)CeO2·xCe+xH2O+ xCO2
(m-x)CeO2·xCe+xO2(m-x)CeO2·xCe+xH2O+ xCO2![]() mCeO2+ xH2+ xCO
mCeO2+ xH2+ xCO
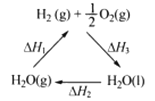
下列说法不正确的是
A. 该过程中CeO2没有消耗
B. 该过程实现了太阳能向化学能的转化
C. 右图中△H1=△H2+△H3
D. 以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH——2e—=CO32-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是由常见元素组成的一些单质及其化合物之间的转化关系图。各方框表示有关的一种反应物或生成物(部分物质已经略去)。其中A、B、D在常温下均为无色无味的气体,C是能使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。

(1)写出C→E的化学方程式: 。
(2)实验室常用加热两种固体混合物的方法制备物质C,其化学方程式为: ,干燥C常用 (填写试剂名称)。
(3)E物质遇到D物质时,会观察到 现象,若用排水法收集F,则最终集气瓶中收集到的气体为 (填写物质的化学式)。
(4)写出A→D的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol/L、2.00 mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、35℃,每次实验HNO3的用量为25.00 mL,大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填空:
实验编号 | 温度(℃) | 大理石规格 | HNO3浓度(mol/L) | 实验目的 |
① | 25 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究浓度对反应速率的影响;(Ⅱ)实验①和③探究温度对反应速率的影响;(Ⅲ)实验①和④探究________对反应速率的影响 |
② | 25 | 粗颗粒 | _______ | |
③ | _______ | 粗颗粒 | 2.00 | |
④ | _________ | 细颗粒 | ______ |
(2)实验①中CO2质量随时间变化的关系见下图。计算实验①中70 s~90 s范围内用HNO3表示的平均反应速率________(忽略溶液体积变化,不需要写出计算过程)。在O~70、70~90、90~200各相同的时间段里,反应速率最大的时间段是________。
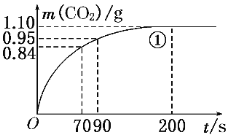
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃A是一种重要的化工原料,己知气体A在标准状况下相对氢气的密度为13,B可发生银镜反应,它们之间的转化关系如右图。请回答:

(1)有机物C中含有的官能团名称是________,反应③的反应类型是____________。
(2)反应①的原子利用率达100%,该反应的化学方程式是______________________。
(3)下列说法正确的是__________________。
A.反应④也能实现原子利用率100%
B.乙酸乙酯在氢氧化钠溶液中水解的反应叫作皂化反应
C.有机物A、B、C均能使酸性高锰酸钾溶液褪色
D.有机物B和D都可以与新制碱性氢氧化铜悬浊液发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式或电离方程式书写正确的是( )
A.铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
B.硝酸银溶液中加入铁粉:Ag++Fe=Fe2++Ag
C.硫酸氢钠的电离方程式:NaHSO4=Na+ + H+ + SO42-
D.碳酸氢钠的电离方程式:NaHCO3=Na+ + H++ CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com