
【题目】如表是A、B、C、D四种常见有机物的相关信息。
有机物A | 有机物B | 有机物C | 有机物D |
①可用于果实催熟 ②比例模型为 | ①由C、H两种元素组成 ②球棍模型为 | ①生活中常见的液态有机物,分子中碳原子数与有机物A相同, ②能与Na反应,但不能与NaOH反应 | ①相对分子质量比有机物C大14 ②能由有机物C氧化生成 |
根据表中信息回答下列问题:
(1)有机物A的分子式为________。
(2)下列有关有机物A、B的说法正确的是________(填字母)。
a.A、B均可使酸性KMnO4溶液褪色
b.A、B分子中所有的原子在同一平面内
c.等质量的A、B完全燃烧,消耗氧气的量相同
d.A、B分子均含有碳碳双键,能发生加成反应
(3)写出有机物C的同分异构体的结构简式:________。
(4)在一定条件下,有机物C与有机物D反应能生成具有水果香味的物质E,其化学反应方程式为_______,某次实验中,以5.0gD为原料,制得4.4gE,则D的转化率为_____。
【答案】C2H4 b CH3OCH3 CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O 60%
CH3COOCH2CH3+H2O 60%
【解析】
根据有机物A的用途和比例模型,推出A为乙烯,有机物B由C、H两种元素组成,说明是烃,根据球棍模型,有机物B为苯,有机物C为生活中常见的液态有机物,含有2个碳原子,有机物C能与Na发生反应,但不能与NaOH反应,说明有机物C为乙醇,有机物D的分子量比乙醇大14,即有机物D的分子量为60,且有机物D由有机物C氧化生成,即有机物D为乙酸,据此分析;
(1)有机物A可用于果实催熟,以及比例模型,推出有机物A为乙烯,即分子式为C2H4;
(2)有机物A为乙烯,有机物B由C、H两种元素组成,说明有机物B是烃,根据球棍模型,推出有机物B为苯,
a、乙烯中含有碳碳双键,能使酸性高锰酸钾溶液褪色,苯中不含不饱和键,不能使酸性高锰酸钾溶液褪色,故a错误;
b、乙烯空间构型为平面型,苯的空间构型为平面正六边形,两者所有的原子在同一平面,故b正确;
c、C2H4燃烧的反应方程式为C2H4+3O2→2CO2+2H2O,1g乙烯消耗氧气的物质的量为![]() mol,苯与氧气反应:C6H6+
mol,苯与氧气反应:C6H6+![]() O2→6CO2+3H2O,1g苯燃烧消耗氧气的量为
O2→6CO2+3H2O,1g苯燃烧消耗氧气的量为![]() mol,等质量C2H4和苯,前者耗氧量大于后者,故c错误;
mol,等质量C2H4和苯,前者耗氧量大于后者,故c错误;
d、苯中不含碳碳双键,故d错误;
答案选b;
(3)有机物C为生活中常见的液态有机物,含有2个碳原子,有机物C能与Na发生反应,但不能与NaOH反应,说明有机物C含有羟基,即有机物C为乙醇,乙醇的结构简式为CH3CH2OH,与乙醇互为同分异构体的结构简式为CH3OCH3;
(4)有机物D的分子量比乙醇大14,即有机物D的分子量为60,且有机物D由有机物C氧化生成,即有机物D为乙酸,乙酸与乙醇发生酯化反应,反应方程式为CH3CH2OH+CH3COOH ![]() CH3COOCH2CH3+H2O,制得4.4g乙酸乙酯,消耗乙酸的物质的量为
CH3COOCH2CH3+H2O,制得4.4g乙酸乙酯,消耗乙酸的物质的量为![]() =0.05mol,消耗乙酸的质量为0.05mol×60g·mol-1=3g,即乙酸转化率为
=0.05mol,消耗乙酸的质量为0.05mol×60g·mol-1=3g,即乙酸转化率为![]() ×100%=60%。
×100%=60%。


科目:高中化学 来源: 题型:
【题目】四种短周期元素X、Y、Z、W在周期表中的位置如图所示,其中Z元素的最外层电子数是内层电子总数的1/2。下列说法不正确的是

A.Z元素位于周期表的第3周期第VA族
B.X、W元素的最高价氧化物对应水化物的酸性:W强于X
C.Y元素的气态氢化物的热稳定性比Z的低
D.X与W可形成共价化合物XW2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨时,在某个密闭容器中发生反应:3H2(g)+N2(g)![]() 2NH3(g)
2NH3(g)
(1)下列能使反应速率加快的是_____________________
①升高温度 ②减小容器体积 ③通入N2 ④通入Ar使压强增大 ⑤通入HCl气体 ⑥加入合适的催化剂
A.①③④⑤ B.①②③⑥ C.①②③④ D.②④⑤⑥
(2)在恒温、恒容的条件下,下列说法能表示反应达到化学平衡状态的是__________
①当有1molN2被消耗,就有2molNH3生成
②当有6molH—H键形成时,就有12molN—H键形成
③2![]() 正(N2)=
正(N2)=![]() 逆(NH3)
逆(NH3)
④N2的物质的量不再变化
⑤H2、N2、NH3的浓度之比等于3:1:2
⑥混合气体的密度不变
⑦混合气体的压强不变
⑧混合气体的平均相对分子质量不变
A.①③④⑤⑦ B.①②③④⑧ C.②③④⑦⑧ D.②④⑤⑥
(3)在2 L定容密闭容器中通入1 mol N2(g)和3 mol H2(g),发生反应:3H2(g)+N2(g)![]() 2NH3(g)(放热反应)。测得压强-时间图像如图甲,测得p2=0.8p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如图乙图像。
2NH3(g)(放热反应)。测得压强-时间图像如图甲,测得p2=0.8p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如图乙图像。
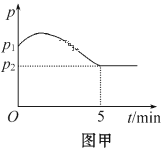
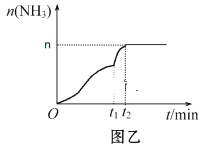
①如图甲,反应开始至平衡时NH3的平均反应速率为_____________________,平衡时氢气的转化率为_________。
②如图乙,下列说法正确的是_________
A.t1时刻可能是加入了催化剂
B.改变条件可以使H2 100℅转化为NH3
C.增大N2的浓度,可以提高H2的转化率
D.t2时刻,N2的浓度与NH3的浓度之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制100 mL 1.0 mol/LNa2CO3溶液,下列操作正确的是
A. 称取10.6 g无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容
B. 称取10.6 g无水碳酸钠,加入100 mL蒸馏水,搅拌、溶解
C. 转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中
D. 定容后,塞好瓶塞,反复倒转、摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是
A. CaCO3+2HCl=CaCl2+CO2↑+ H2O
B. CaO+H2O=Ca(OH)2
C. 2H2O2![]() 2H2O+O2↑
2H2O+O2↑
D. CaCO3![]() CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】指出下列分子中带*号的原子采用的杂化方式:
(1)HO2________
(2) _________
_________
(3)*CO2________
(4)CHCH2OH_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置的说法不正确的是
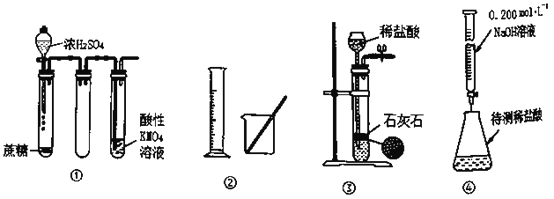
A.装置①中酸性高锰酸钾溶液中出现气泡,且颜色逐渐褪去
B.利用②中仪器可以配置75%的酒精溶液
C.装置③可用于实验室制备CO2气体
D.装置④可用来测定未知浓度的稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M溶液受热会发生分解反应。体积均为2L的4组溶液(忽略反应前后体积的变化),M的物质的量随时间的变化如下表,则下列说法不正确的是
0min | 10min | 20min | 30min | 40min | 50min | 60min | ||
① | 10℃ | 1.1 | 0.90 | 0.80 | 0.73 | 0.68 | 0.65 | 0.65 |
② | 10℃ | a | 0.70 | 0.65 | 0.65 | 0.65 | 0.65 | 0.65 |
③ | 25℃ | 1.0 | 0.70 | 0.50 | 0.35 | 0.25 | 0.20 | 0.20 |
④ | 30℃ | 2.0 | 1.4 | 0.90 | 0.50 | 0.20 | 0.13 | 0.13 |
A.在10-20min内,实验①中M的平均分解速率为0.005mol/(L·min)
B.a>1.1,且说明浓度越大反应速率越快
C.对比实验①和④,不能说明M的平均反应速率随温度升高而增大
D.不考虑其它影响因素,仅由③可知,反应物浓度越大反应速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各图的叙述正确的是
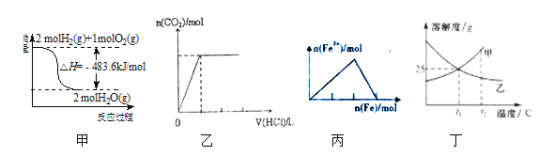
A.甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8kJmol-1
B.乙表示向碳酸钠溶液中逐滴滴加稀盐酸,生成CO2与所加盐酸的物质的量的关系
C.丙表示在稀硝酸溶液中加入铁粉,溶液中Fe3+的变化曲线
D.丁表示t1℃时质量分数均为20%的甲、乙两种溶液,升温到t2℃时,两种溶液中溶质的质量分数仍然相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com