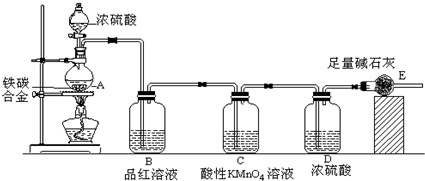
解:由装置图可知,该实验原理:通过测定干燥管E的质量增重确定二氧化碳的质量,根据二氧化碳的质量计算铁碳合金中碳的质量,进而计算铁的质量,再计算合金中铁的质量分数.故二氧化硫会影响二氧化碳的测定,进入干燥管E的气体应除去二氧化硫、且干燥.
(1)常温下,铁与浓硫酸反应生成一层致密的氧化物保护膜,阻止内金属继续与浓硫酸反应,发生钝化现象,
故答案为:常温下Fe遇浓硫酸发生钝化;
(2)碳与浓硫酸在加热的条件下生成二氧化硫、二氧化碳、水,反应方程式为C+2H
2SO
4(浓)

CO
2↑+2SO
2↑+2H
2O,
故答案为:C+2H
2SO
4(浓)

CO
2↑+2SO
2↑+2H
2O;
(3)A中生成的气体含有CO
2、2SO
2,SO
2具有漂白性,能使品红溶液褪色;
C装置的作用为除尽反应产物中的SO
2气体,防止影响二氧化碳的质量测定,
故答案为:品红溶液褪色;除尽反应产物中的SO
2气体;
(4)E增重b g为二氧化碳的质量,根据碳元素守恒可知合金中碳元素的质量为

bg,合金中铁的质量为mg-

bg=(m-
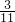
b)g,故铁的质量分数
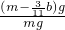
=

,
故答案为:

;
(5)装置内残留部分二氧化碳,未能被装置E完全吸收,导致测量的二氧化碳的质量偏小,即合金中碳元素的质量偏小,铁元素的质量增大,质量分数增大,
故答案为:装置内的CO
2难以赶尽,导致E质量增重偏小;
(6)由装置图可知,SO
2不一定能全部被品红KMnO
4除去,E中碱石灰会吸收空气中的CO
2、H
2O等,
故答案为:SO
2不一定能全部被品红KMnO
4除去或E中碱石灰会吸收空气中的CO
2、H
2O等.
分析:由装置图可知,该实验原理:通过测定干燥管E的质量增重确定二氧化碳的质量,根据二氧化碳的质量计算铁碳合金中碳的质量,进而计算铁的质量,再计算合金中铁的质量分数.故二氧化硫会影响二氧化碳的测定,进入干燥管E的气体应除去二氧化硫、且干燥.
(1)常温下碳与浓硫酸不反应,铁在浓硫酸中发生钝化现象;
(2)碳与浓硫酸在加热的条件下生成二氧化硫、二氧化碳、水;
(3)A中生成的气体含有CO
2、2SO
2,SO
2具有漂白性,能使品红溶液褪色;
二氧化硫存在会影响二氧化碳的质量测定,C装置的作用为除尽反应产物中的SO
2气体;
(4)E增重b g为二氧化碳的质量,根据碳元素守恒计算合金中碳元素的质量,合金的质量减去碳元素质量等于铁的质量,再根据质量分数定义计算;
(5)装置内残留部分二氧化碳,未能被装置E完全吸收,导致测量的二氧化碳的质量偏小,即合金中碳元素的质量偏小;
(6)由装置图可知,SO
2不一定能全部被品红KMnO
4除去,E中碱石灰会吸收空气中的CO
2、H
2O等.
点评:本题考查学生对实验原理的理解、对实验方案与实验装置的评价、元素化合物性质、化学计算等,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.

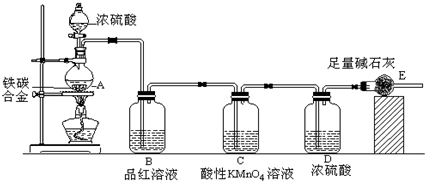
 CO2↑+2SO2↑+2H2O,
CO2↑+2SO2↑+2H2O, CO2↑+2SO2↑+2H2O;
CO2↑+2SO2↑+2H2O; bg,合金中铁的质量为mg-
bg,合金中铁的质量为mg- bg=(m-
bg=(m-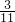 b)g,故铁的质量分数
b)g,故铁的质量分数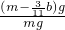 =
= ,
, ;
;