
【题目】在石蜡油的分解实验中,产物可使酸性高锰酸钾溶液褪色,也可以使溴的四氯化碳溶液褪色。

请你根据实验过程及现象探讨下列问题:
(1)碎瓷片的作用是__。
(2)分解产物中的气体是否都是烷烃__,你的依据是__。
(3)证明石蜡油分解产物中含有碳、氢元素的方法是__。
【答案】碎瓷片可起到催化剂的作用,促进石蜡油分解 产物中的气体一定不都是烷烃 因为烷烃是饱和烃,与甲烷性质相似,不能使酸性高锰酸钾溶液褪色,也不可能使溴的四氯化碳溶液褪色 在气体产物燃烧火焰的上方罩一干冷烧杯,若烧杯内壁有水珠,证明有氢元素;在火焰的上方罩一内壁附着澄清石灰水的烧杯,若出现浑浊现象,证明含有碳元素
【解析】
石蜡油在碎瓷片的催化作用下,分解的产物能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色,一定有不饱和烃(烯烃或乙烯)生成,据此分析解答。
(1)石蜡油分解较缓慢,加热碎瓷片能加快反应速率,碎瓷片还能吸收热量而积蓄热量从而促进石蜡油分解,起到催化剂作用;故答案为:碎瓷片可起到催化剂的作用,促进石蜡油分解;
(2)已知产物可使酸性高锰酸钾溶液褪色,也可以使溴的四氯化碳溶液褪色,则产物中的气体一定不都是烷烃,还有不饱和烃(烯烃或乙烯);故答案为:产物中的气体一定不都是烷烃;因为烷烃是饱和烃,与甲烷性质相似,不能使酸性高锰酸钾溶液褪色,也不可能使溴的四氯化碳溶液褪色;
(3)将气体产物点燃,并检验燃烧产物中有二氧化碳和水生成,故答案为:在气体产物燃烧火焰的上方罩一干冷烧杯,若烧杯内壁有水珠,证明有氢元素;在火焰的上方罩一内壁附着澄清石灰水的烧杯,若出现浑浊现象,证明含有碳元素。


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】(1)将NO2球置于热水中,气体颜色_____(填“加深”、“变浅”),说明2NO2(g)![]() N2O4(g)
N2O4(g) ![]() H______0(填“>”、“<”)。
H______0(填“>”、“<”)。
(2)硫代硫酸钠溶液与稀硫酸混合,反应的离子方程式为____________。
(3)向淀粉碘化钾试纸上加入几滴稀硫酸,一段时间后,试纸变蓝,发生反应的离子方程式为_____。
(4)已知![]() 液态肼(N2H4)和足量
液态肼(N2H4)和足量![]() 反应,生成氮气和水蒸气,放出
反应,生成氮气和水蒸气,放出![]() 的热量。写出该反应的热化学方程式__。
的热量。写出该反应的热化学方程式__。
(5)已知下列热化学方程式:
①![]()
![]()
![]()
![]()
![]()
![]()
写出![]() 被CO还原成Fe和
被CO还原成Fe和![]() 的热化学方程式____________。
的热化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d为原子半径依次增大的四种短周期主族元素,其中元素a的最高正价与最低负价的代数和等于0,b、c能形成摩尔质量相同的两种单质,b、d则能化合成淡黄色的固体。下列有关判断不正确的是
A. 核电荷数大小:c>d>b>a
B. 简单氢化物的热稳定性:b>c
C. b能分别与a、c、d形成具有漂白性的物质
D. c与a形成的化合物分子中,各原子均达到8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯是一种重要的化工原料。可由丙烷催化脱氢制备。
主反应:①C3H8(g)=C3H6(g)+H2(g) ΔH1
副反应:②C3H8(g)=C2H4(g)+CH4(g)
③C2H4(g)+H2(g)=C2H6(g)
④C3H8(g)+H2(g)=C2H6(g)+CH4(g)
回答下列问题:
(1)已知:C3H8(g)+![]() O2(g)=C3H6(g)+H2O(g) ΔH2=-117kJ/mol
O2(g)=C3H6(g)+H2O(g) ΔH2=-117kJ/mol
H2(g)+![]() O2(g)=H2O(g) ΔH3=-242kJ/mol。反应①的ΔH1=___。
O2(g)=H2O(g) ΔH3=-242kJ/mol。反应①的ΔH1=___。
(2)某温度下,在体积不变的密闭容器内发生反应①,起始总压强为105Pa,平衡时总压增加了20%。则C3H8的转化率为___;该反应的平衡常数Kp=___Pa。若提高C3H8的平衡转化率,可采取的措施有___(填标号)。
A.增大C3H8的浓度
B.提高温度
C.恒容下通入惰性气体
D.使用高效催化剂
(3)工业生产中常采用恒压下充入高温水蒸气的条件。如图表示常压下反应①C3H8的平衡转化率与温度及水烃比(M)的关系,M2___5(填“>”或“<”)。
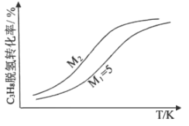
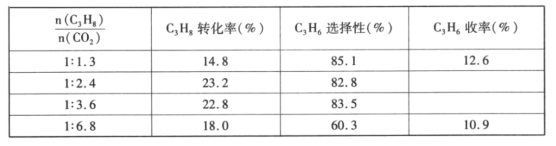
(4)已知高温下C-C键断裂反应比C-H键断裂的脱氢反应容易发生,这将导致丙烯选择性降低;同时高温加剧催化剂表面积炭,导致催化剂迅速失活。在生产中充入CO2的作用之一是利于催化剂活性保持,其原因是___。反应气中![]() 的配比对催化剂活性的影响如表所示。其中C3H6收率最高时
的配比对催化剂活性的影响如表所示。其中C3H6收率最高时![]() 的配比是___。
的配比是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸牛奶中含有乳酸,其结构简式为![]() 。回答下列问题:
。回答下列问题:
(1)乳酸跟足量金属钠反应的化学方程式是__。
(2)乳酸跟少量碳酸氢钠反应的化学方程式是_。
(3)乳酸在浓硫酸存在下,两分子相互反应,生成链状物质的结构简式为_。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】李兰娟院士团队在救治感染新型冠状病毒患者过程中,发现达芦那韦对新冠病毒有一定的抑制作用。下列有关该物质的说法正确的是
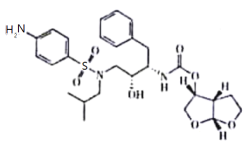
A.含有苯环,属于芳香烃
B.苯环上的一溴代物代物有5种同分异构体
C.1 mol该物质最多能与7 mol H2发生加成反应
D.不能溶于水、酸溶液、碱溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。
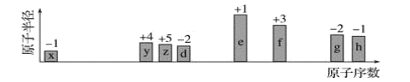
根据判断出的元素回答问题:
(1)f在周期表中的位置是________。
(2)比较d、e常见离子的半径大小(用化学式表示,下同):________>________;比较g、h的最高价氧化物对应水化物的酸性强弱________>________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式:_________________________。
(4)e的单质在足量![]() 中燃烧的化学方程式:_________________________。
中燃烧的化学方程式:_________________________。
(5)上述元素可组成盐![]() 。向盛有
。向盛有![]() 溶液的烧杯中滴加
溶液的烧杯中滴加![]() 溶液,沉淀物质的量随
溶液,沉淀物质的量随![]() 溶液体积的变化示意图如下:
溶液体积的变化示意图如下:
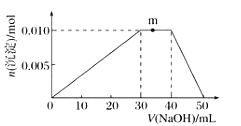
①R溶液的电离方程式____________________________。
②写出m点反应的离子方程式:____________________。
③若在R溶液中改加![]() 溶液,充分反应后,溶液中产生沉淀的物质的量为________
溶液,充分反应后,溶液中产生沉淀的物质的量为________![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时0.1 mol·L-1醋酸溶液的pH约为3,向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了c(OH-),因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
(1)上述两种解释中________(填“甲”或“乙”)正确。
(2)为了验证上述哪种解释正确,继续做如下实验:向0.1 mol·L-1的醋酸溶液中加入少量下列物质中的________(填写编号字母),然后测定溶液的pH。
A.固体CH3COOK | B.固体CH3COONH4 |
C.气体NH3 | D.固体NaHCO3 |
(3)若________(填“甲”或“乙”)的解释正确,溶液的pH应________(填“增大”、“减小”或“不变”)(已知25 ℃ 时,CH3COONH4溶液呈中性)。
(4)常温下将0.010 mol CH3COONa和0.004 mol HCl溶于水,配制成0.5 L混合溶液。判断:
①溶液中共有________种粒子。
②溶液中有两种粒子的物质的量的和一定等于0.010 mol,它们是________和________。
③溶液中n(CH3COO-)+n(OH-)-n(H+)=________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为原电池装置示意图。
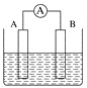
(1)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,作负极的分别是_____(填字母)。
A.铝片、铜片 B.铜片、铝片
C.铝片、铝片 D.铜片、铜片
写出插入烧碱溶液中形成的原电池的负极反应式____
(2)若A为Pb,B为PbO2,电解质为H2SO4溶液,工作时的总反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O。写出B电极反应式___,该电池在工作时,A电极的质量将___(填“增加”“减小”或“不变”)。若该电池反应消耗了0.1 mol H2SO4,则转移电子的数目为___。
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为氢氧燃料电池,写出A电极反应式:_____;该电池在工作一段时间后,溶液的碱性将_____(填“增强”“减弱”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com