
【题目】(1)将NO2球置于热水中,气体颜色_____(填“加深”、“变浅”),说明2NO2(g)![]() N2O4(g)
N2O4(g) ![]() H______0(填“>”、“<”)。
H______0(填“>”、“<”)。
(2)硫代硫酸钠溶液与稀硫酸混合,反应的离子方程式为____________。
(3)向淀粉碘化钾试纸上加入几滴稀硫酸,一段时间后,试纸变蓝,发生反应的离子方程式为_____。
(4)已知![]() 液态肼(N2H4)和足量
液态肼(N2H4)和足量![]() 反应,生成氮气和水蒸气,放出
反应,生成氮气和水蒸气,放出![]() 的热量。写出该反应的热化学方程式__。
的热量。写出该反应的热化学方程式__。
(5)已知下列热化学方程式:
①![]()
![]()
![]()
![]()
![]()
![]()
写出![]() 被CO还原成Fe和
被CO还原成Fe和![]() 的热化学方程式____________。
的热化学方程式____________。
【答案】加深 < S2O32-+2H+=S↓+SO2↑+H2O 4H++O2+4I—=2H2O+2I2 ![]()
![]() )
)![]()
【解析】
(1)热水会使球中气体颜色加深,根据温度对平衡的影响效果作答;
(2)硫代硫酸钠溶液与稀硫酸会发生氧化还原反应;
(3)碘离子在酸性条件下被空气氧化为碘单质;
(4)计算1mol液态肼与足量液态双氧水反应时放出的热量,可写出反应的热化学方程式;
(5)根据盖斯定律分析作答。
(1)将NO2球置于热水中,球中气体颜色会加深,说明二氧化氮浓度增大,即升高温度平衡2NO2(g)![]() N2O4(g)向生成NO2方向移动,
N2O4(g)向生成NO2方向移动,![]() H<0,故答案为:加深;<;
H<0,故答案为:加深;<;
(2)硫代硫酸钠溶液与稀硫酸反应生产硫单质、二氧化硫和水,其反应的离子方程式为:S2O32—+2H+=S↓+SO2↑+H2O;
(3)向淀粉碘化钾溶液滴几滴稀硫酸后溶液变为蓝色,则说明碘离子与氧气在酸性条件下发生了氧化还原反应,其反应的离子方程式为4H++4I-+O2=2I2+2H2O;
(4)0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量,则1mol液态肼与足量液态双氧水反应时放出的热量641.625kJ,其热化学方程式为:![]()
![]() ;
;
(5)①![]()
![]()
![]()
![]()
![]()
![]()
则根据盖斯定律①×![]() -②×
-②×![]() +③,得Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=(-393.5×
+③,得Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=(-393.5×![]() -172.46×
-172.46×![]() +824.21) kJmol-1=-24.73kJmol-1,故答案为:
+824.21) kJmol-1=-24.73kJmol-1,故答案为:![]() 。
。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】标况下将8.96 L氯化氢气体溶于水形成100 mL溶液,然后与足量的铁屑反应。
(1)所得盐酸溶液的物质的量浓度是多少________?
(2)参加反应的铁的质量是多少________?
(3)标况下生成氢气的体积是多少________?
(4)将生成的氯化亚铁配成400 mL溶液,此溶液中氯化亚铁的物质的量浓度是多少________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2;CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s)△CuSO4(s)+5H2O(l), 热效应为△H3。则下列判断正确的是
A. △H2>△H3 B. △H1<△H3
C. △H1+△H3=△H2 D. △H1+△H2>△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金币、银币、铜币等金属货币在我国历史上曾经发挥过重要作用,其中一些被收藏爱好者珍藏。在一位收藏家的家中,陈列了很多金属货币。其中有些货币表面是黑色的,且有少量的绿色锈状物。回答下列问题:
(1)该收藏家的这些货币是__________币;
(2)货币表面的黑色物质是__________,形成这种物质的化学方程式为_____________;
(3)货币表面的绿色物质是____________,形成这种物质的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应N2O4![]() 2NO2在温度一定时,平衡体系中NO2的体积分数V(NO2)%随压强的变化情况如图所示。下列说法正确的是
2NO2在温度一定时,平衡体系中NO2的体积分数V(NO2)%随压强的变化情况如图所示。下列说法正确的是
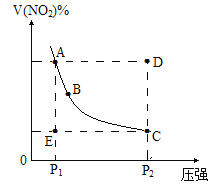
A.A、C两点的正反应速率的关系![]()
B.A、B、C、D、E各状态,![]() 的是状态E
的是状态E
C.维持![]() 不变,
不变,![]() 所需时间为x,维持
所需时间为x,维持![]() 不变,
不变,![]() 所需时间为y,则
所需时间为y,则![]()
D.使E状态从水平方向到达C状态,从理论上来讲,可选用的条件是从![]() 突然加压至
突然加压至![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将70g过氧化钠和氧化钠混合物与98g水充分反应,所得溶液恰好能被含硫酸98g的酸溶液中和,求:
(1)原混合物中过氧化钠和氧化钠的质量分别是多少?___
(2)所得氢氧化钠溶液的质量分数是多少?___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Zn3(PO4)2·2H2O(溶于酸,难溶于水)是一种无毒害作用的防锈颜料,利用锌浮渣(主要含Zn、ZnO、ZnCl2,还含少量的铁、锰、铜、铅及砷的化合物等)制取Zn3(PO4)2·2H2O的工艺流程如图:
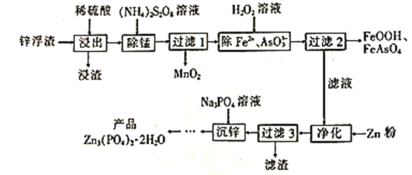
回答下列问题:
(1)“浸出”时,下列措施能提高锌的浸取率的是__(填字母)。
A.用浓硫酸代替稀硫酸 B.适当升高浸取液的温度
C.将“浸渣”再次浸取 D.缩短“浸出”时间
(2)“除锰”时,Mn2+发生反应的离子方程式为__(S2O![]() 被还原为SO
被还原为SO![]() )。
)。
(3)流程中除铁、砷时,当生成8.9gFeOOH和7.8gFeAsO4时,消耗H2O2__mol。
(4)“净化”时加锌粉的目的是__。
(5)“沉锌”时发生反应的化学方程式为__。
(6)“沉锌”至得到“产品”还需要经过的操作是__、洗涤、__。证明产品已洗涤干净的实验方法是__。
(7)Meyer等认为磷酸锌防腐机理是在钢铁表面形成组成近似为Zn2Fe(PO4)2·4H2O的覆盖膜,则在形成该覆盖膜的过程中,负极的电极反应式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】异丁香酚可作为合成香料的原料,其结构简式如下图所示。下列有关叙述正确的是( )
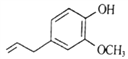
A. 异丁香酚属于芳香族化合物,分子式为C10H14O2
B. 该物质能使酸性高锰酸钾溶液褪色
C. 1mol该物质与足量H2发生加成反应,最多可消耗1molH2
D. 分子中所有原子有可能在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在石蜡油的分解实验中,产物可使酸性高锰酸钾溶液褪色,也可以使溴的四氯化碳溶液褪色。

请你根据实验过程及现象探讨下列问题:
(1)碎瓷片的作用是__。
(2)分解产物中的气体是否都是烷烃__,你的依据是__。
(3)证明石蜡油分解产物中含有碳、氢元素的方法是__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com