
【题目】金币、银币、铜币等金属货币在我国历史上曾经发挥过重要作用,其中一些被收藏爱好者珍藏。在一位收藏家的家中,陈列了很多金属货币。其中有些货币表面是黑色的,且有少量的绿色锈状物。回答下列问题:
(1)该收藏家的这些货币是__________币;
(2)货币表面的黑色物质是__________,形成这种物质的化学方程式为_____________;
(3)货币表面的绿色物质是____________,形成这种物质的化学方程式为__________。
【答案】铜 氧化铜 2Cu+O2![]() 2CuO 碱式碳酸铜 2Cu+O2+H2O+CO2=Cu2(OH)2CO3
2CuO 碱式碳酸铜 2Cu+O2+H2O+CO2=Cu2(OH)2CO3
【解析】
根据铜比银、金活泼,能与空气中氧气发生反应生成氧化铜,也能与空气中氧气、水及CO2一起发生反应而得到铜锈,氧化铜和碱式碳酸铜都可溶于强酸分析;根据银和金都不活泼,不易被氧化分析。
(1) 铜能与氧气反应生成黑色的氧化铜,能与氧气、水、二氧化碳反应生成绿色的碱式碳酸铜。金币性质稳定,年代久远也会保持其金属光泽;银币保存长久时,会因与空气中的硫化物、空气、水分等发生反应生成了硫化银而变黑。.货币表面为黑色,且有少量的绿色锈状物质,说明为铜币,
故答案为:铜;
(2)铜在铜、银、金中比较活泼,能与空气中氧气发生反应生成氧化铜,化学方程式为2Cu+O2![]() 2CuO,
2CuO,
故答案为:氧化铜 ;2Cu+O2![]() 2CuO;
2CuO;
(3)铜也能与空气中氧气、水及CO2一起发生反应生成Cu2(OH)2CO3,化学方程式为2Cu+O2+H2O+CO2=Cu2(OH)2CO3
故答案为:碱式碳酸铜;2Cu+O2+H2O+CO2=Cu2(OH)2CO3;


科目:高中化学 来源: 题型:
【题目】等质量的甲、乙、丙三种金属,分别与足量的溶质质量分数相同的稀硫酸完全反应后,都生成+2价的硫酸盐,其产生氢气的体积与反应时间的关系如图所示,则下列说法正确的是
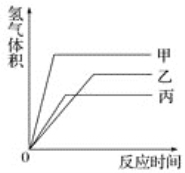
A. 三种金属的活动性顺序为甲>乙>丙
B. 反应结束消耗硫酸的质量一定相同
C. 三种金属的相对原子质量是甲>乙>丙
D. 甲先反应完,乙最后反应完
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抗菌化合物X可由埃及地中海沿岸采集的沉积物样品中分离得到,其结构简式如图所示。下列有关化合物X的说法正确的是( )
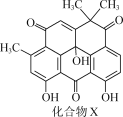
A.分子中有两个手性碳原子
B.分子中所有碳原子位于同一平面
C.能与酸性KMnO4溶液反应
D.1mol化合物X至多与1molBr2发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像分别表示有关反应的反应过程与能量变化的关系,其中判断正确的是( )
A. 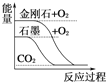 石墨转变成金刚石是吸热反应
石墨转变成金刚石是吸热反应
B. 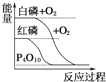 白磷比红磷稳定
白磷比红磷稳定
C. 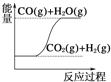 CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0
D. 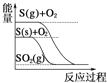 S(g)+O2(g)=SO2(g) ΔH1 S(s)+O2(g)=SO2(g) ΔH2,则ΔH1>ΔH2
S(g)+O2(g)=SO2(g) ΔH1 S(s)+O2(g)=SO2(g) ΔH2,则ΔH1>ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关钠的化合物说法正确的是( )
A. 将NaOH浓溶液滴加到饱和FeCl3溶液中制备Fe(OH)3胶体
B. 用加热法除去NaHCO3固体中混有的Na2CO3
C. 灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,一定没有K+
D. Na2O2可用于呼吸面具中氧气的来源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在体积为1L的密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图。下列叙述中正确的是

A.反应的化学方程式为![]()
B.![]() 时,Y的浓度是X浓度的
时,Y的浓度是X浓度的![]() 倍
倍
C.根据![]() 时的数据,可求出该温度下的平衡常数
时的数据,可求出该温度下的平衡常数
D.![]() 时,逆反应速率大于正反应速率
时,逆反应速率大于正反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将NO2球置于热水中,气体颜色_____(填“加深”、“变浅”),说明2NO2(g)![]() N2O4(g)
N2O4(g) ![]() H______0(填“>”、“<”)。
H______0(填“>”、“<”)。
(2)硫代硫酸钠溶液与稀硫酸混合,反应的离子方程式为____________。
(3)向淀粉碘化钾试纸上加入几滴稀硫酸,一段时间后,试纸变蓝,发生反应的离子方程式为_____。
(4)已知![]() 液态肼(N2H4)和足量
液态肼(N2H4)和足量![]() 反应,生成氮气和水蒸气,放出
反应,生成氮气和水蒸气,放出![]() 的热量。写出该反应的热化学方程式__。
的热量。写出该反应的热化学方程式__。
(5)已知下列热化学方程式:
①![]()
![]()
![]()
![]()
![]()
![]()
写出![]() 被CO还原成Fe和
被CO还原成Fe和![]() 的热化学方程式____________。
的热化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸亚铁晶体{[CH3CH(OH)COO]2Fe3H2O}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3 反应制得:2CH3CH(OH)COOH+FeCO3+2H2O→[CH3CH(OH)COO]2Fe3H2O+CO2↑。
Ⅰ.制备FeCO3:装置如图所示。
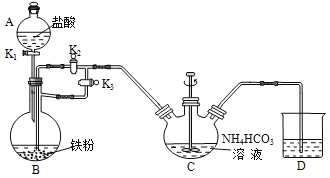
(1)B的名称是____。
(2)①清洗仪器,检查装置气密性的方法是:在D处导管末端套上夹止水夹的橡胶管,在A中加入水,分别打开活塞K1和K3。关闭活塞K2,若观察到___,则气密性良好。
②倒掉A中的水,加入盐酸,在B中加入铁粉、C中加入NH4HCO3溶液。关闭活塞K2,打开活塞K1和K3;滴入足量盐酸后,关闭活塞K1,开动搅拌器,反应一段时间后关闭活塞K3,打开活塞K2,C中发生的反应的离子方程式为____。
Ⅱ.制备乳酸亚铁晶体:将制得的FeCO3加入乳酸溶液中,加入少量铁粉,在75℃下搅拌使之充分反应。然后再加入适量乳酸。
(3)加入少量铁粉的作用是___。从所得溶液中获得乳酸亚铁晶体所需的实验操作是:隔绝空气低温蒸发,冷却结晶,____、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯是一种重要的化工原料。可由丙烷催化脱氢制备。
主反应:①C3H8(g)=C3H6(g)+H2(g) ΔH1
副反应:②C3H8(g)=C2H4(g)+CH4(g)
③C2H4(g)+H2(g)=C2H6(g)
④C3H8(g)+H2(g)=C2H6(g)+CH4(g)
回答下列问题:
(1)已知:C3H8(g)+![]() O2(g)=C3H6(g)+H2O(g) ΔH2=-117kJ/mol
O2(g)=C3H6(g)+H2O(g) ΔH2=-117kJ/mol
H2(g)+![]() O2(g)=H2O(g) ΔH3=-242kJ/mol。反应①的ΔH1=___。
O2(g)=H2O(g) ΔH3=-242kJ/mol。反应①的ΔH1=___。
(2)某温度下,在体积不变的密闭容器内发生反应①,起始总压强为105Pa,平衡时总压增加了20%。则C3H8的转化率为___;该反应的平衡常数Kp=___Pa。若提高C3H8的平衡转化率,可采取的措施有___(填标号)。
A.增大C3H8的浓度
B.提高温度
C.恒容下通入惰性气体
D.使用高效催化剂
(3)工业生产中常采用恒压下充入高温水蒸气的条件。如图表示常压下反应①C3H8的平衡转化率与温度及水烃比(M)的关系,M2___5(填“>”或“<”)。
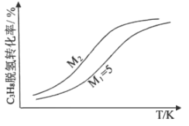
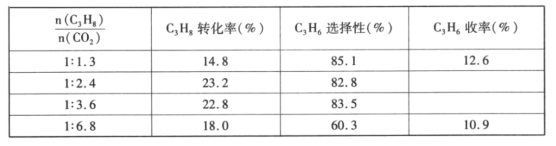
(4)已知高温下C-C键断裂反应比C-H键断裂的脱氢反应容易发生,这将导致丙烯选择性降低;同时高温加剧催化剂表面积炭,导致催化剂迅速失活。在生产中充入CO2的作用之一是利于催化剂活性保持,其原因是___。反应气中![]() 的配比对催化剂活性的影响如表所示。其中C3H6收率最高时
的配比对催化剂活性的影响如表所示。其中C3H6收率最高时![]() 的配比是___。
的配比是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com