
【题目】下列图像分别表示有关反应的反应过程与能量变化的关系,其中判断正确的是( )
A. 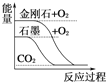 石墨转变成金刚石是吸热反应
石墨转变成金刚石是吸热反应
B. 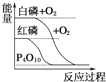 白磷比红磷稳定
白磷比红磷稳定
C. 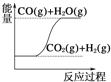 CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0
D. 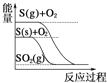 S(g)+O2(g)=SO2(g) ΔH1 S(s)+O2(g)=SO2(g) ΔH2,则ΔH1>ΔH2
S(g)+O2(g)=SO2(g) ΔH1 S(s)+O2(g)=SO2(g) ΔH2,则ΔH1>ΔH2
科目:高中化学 来源: 题型:
【题目】人类对物质结构的探索永无止境。回答下列问题:
(1)碳硼烷酸[化学式为H(CHB11Cl11)是目前世界上已知的最强酸,但腐蚀性很小,可以作为无污染的酸催化剂。现代化学中常利用的___特征谱线来鉴定元素。组成碳硼烷酸的4种元素中,基态原子中未成对电子数最多的是___(填电子排布式)。
(2)石墨炔是我国科学家在2010年首次制得一种新的碳的同素异形体,其中一种结构如图所示,石墨炔中碳原子的杂化类型为___。
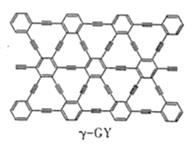
(3)硼元素具有缺电子性。自然界中含硼元素的钠盐是—种天然矿藏,其化学式写作Na2B4O710H2O,实际上它的结构单元是由两个H3BO3和两个[B(OH)4]-缩合而成的双六元环,应该写成Na2[B4O5(OH)4]8H2O。其结构如图所示,它的阴离子可形成链状结构,则该晶体中不存在的作用力是___(填字母)。
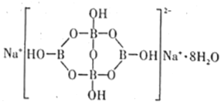
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键
(4)镓与硼元素处于同一主族,GaN是制造5G芯片的材料,可发出紫外光。
①科学家合成了一种阳离子为“N5n+”其结构是对称的,5个N排成“V”形,每个N原子的最外层都达到8电子稳定结构、且含有2个氮氮三键;此后又合成了一种含有“N5n+”化学式为“N8”的离子晶体,N8中阴离子的空间构型为___,写出一种与其互为等电子体的分子___(填化学式)。
②Ga和As两种元素电负性相差不大,能形成化合物GaAs。GaAs的熔点为1238℃,其晶胞结构如图所示。

已知GaAs与GaN具有相同的晶胞结构,则二者晶体的类型均为___,GaAs的熔点___(填“高于”或“低于”)GaN,其理由是___。若Ga和As的原子半径分别为rGa和rAs,则GaAs晶胞中原子的体积占晶胞体积的百分率为___(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以合成氨(低温变换的)废催化剂(主要含Zn、Cu的单质和氧化物)为原料制取ZnCO3·2Zn(OH)2和Cu2O,其实验流程如图:
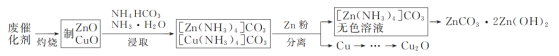
(1)“灼烧”时,需用的硅酸盐质仪器除玻璃棒、酒精灯外,还有___和___。
(2)“浸取”时,生成[Zn(NH3)4]CO3的离子方程式为___。
(3)加“Zn粉”时,为使Zn粉不过量太多{已知:溶液中[Cu(NH3)4]2+呈深蓝色},合适的操作方法及依据的现象是___;分离出的铜粉中混有少量Zn,提纯铜粉的方案是__。
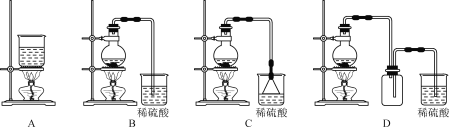
(4)已知反应:[Zn(NH3)4]2+![]() Zn2++4NH3,K=3.5×10-10,由[Zn(NH3)4]CO3溶液制取ZnCO3·2Zn(OH)2,可采用的装置是___(填字母)。
Zn2++4NH3,K=3.5×10-10,由[Zn(NH3)4]CO3溶液制取ZnCO3·2Zn(OH)2,可采用的装置是___(填字母)。
(5)设计以提纯后的铜粉为原料制取Cu2O的实验方案:向烧杯中加入计量的铜粉,__,静置、冷却、过滤、水洗及干燥[已知在约50℃时,发生反应:Cu+H2O2+H2SO4=CuSO4+2H2O。实验中必须使用的试剂:稀硫酸、葡萄糖溶液、10%的NaOH溶液和15%的H2O2溶液]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁盐、铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用,现用铁屑与硫酸反应制备硫酸亚铁。
已知:①4Fe2++O2+4H+===4Fe3++2H2O
②硫酸亚铁在水中的溶解度如下图:
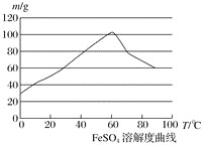
(1)首先,将铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。此步骤中,分离出液体的方法通常不用过滤,使用的操作是____________(填写操作名称)。
(2)向处理过的铁屑中加入适量的硫酸,在一定温度下使其反应到不再产生气体,趁热过滤,得硫酸亚铁溶液。
①硫酸浓度应选择(填字母序号)__________;
A.浓硫酸 B.10 moL·L-1硫酸
C.3 moL·L-1硫酸 D.任意浓度硫酸
②温度宜控制在________,加热的同时需适当补充水,原因是___________________;
③反应中应保持![]() _________ (填“<”“>”或“=”) 1。
_________ (填“<”“>”或“=”) 1。
(3)亚铁盐在空气中易被氧化,但形成复盐可稳定存在,如“摩尔盐”,即(NH4)2SO4·FeSO4·6H2O(硫酸亚铁铵),就是在硫酸亚铁溶液中加入少量稀硫酸溶液,再加入饱和硫酸铵溶液,经过_______、_______、_______、_______等一系列操作后所得。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2;CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s)△CuSO4(s)+5H2O(l), 热效应为△H3。则下列判断正确的是
A. △H2>△H3 B. △H1<△H3
C. △H1+△H3=△H2 D. △H1+△H2>△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼的化合物或合金在储氢、有机合成、超导等方面用途非常广泛。
(1)Mn(BH4)2是一种储氢材料,Mn2+基态核外电子排布式为___。
(2)与环硼氮六烷[分子式为(HNBH)3]互为等电子体的常见分子是___(填结构简式);推测环硼氮六烷在热水、CH3OH中的溶解性:__(填“难”或“易”)溶于热水、CH3OH。
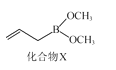
(3)化合物X(如图所示)可由CH2CHCH2MgBr与B(OCH3)3制备。X分子中碳原子的轨道杂化类型为___;1molX分子中含σ键数目为____。
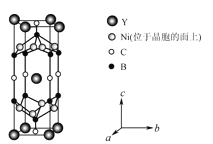
(4)YxNiyBzCw在临界温度15.6K时可实现超导,其晶胞结构如图所示,则其化学式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金币、银币、铜币等金属货币在我国历史上曾经发挥过重要作用,其中一些被收藏爱好者珍藏。在一位收藏家的家中,陈列了很多金属货币。其中有些货币表面是黑色的,且有少量的绿色锈状物。回答下列问题:
(1)该收藏家的这些货币是__________币;
(2)货币表面的黑色物质是__________,形成这种物质的化学方程式为_____________;
(3)货币表面的绿色物质是____________,形成这种物质的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将70g过氧化钠和氧化钠混合物与98g水充分反应,所得溶液恰好能被含硫酸98g的酸溶液中和,求:
(1)原混合物中过氧化钠和氧化钠的质量分别是多少?___
(2)所得氢氧化钠溶液的质量分数是多少?___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家合成出了一种高效电解质(如图所示),其中X、Y、Z、W、Q均为短周期元素,且原子序数依次增大,Z和Q位于同一主族,Y和W的原子序数之和与Q相等。下列说法正确的是
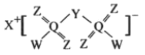
A.Q的氧化物对应水化物为强酸
B.该电解质阴离子中所有原子均满足8电子稳定结构
C.元素非金属性强弱的顺序为W>Y>Z
D.X和Z形成的化合物溶于水呈碱性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com