
【题目】亚铁盐、铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用,现用铁屑与硫酸反应制备硫酸亚铁。
已知:①4Fe2++O2+4H+===4Fe3++2H2O
②硫酸亚铁在水中的溶解度如下图:
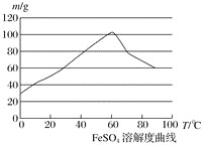
(1)首先,将铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。此步骤中,分离出液体的方法通常不用过滤,使用的操作是____________(填写操作名称)。
(2)向处理过的铁屑中加入适量的硫酸,在一定温度下使其反应到不再产生气体,趁热过滤,得硫酸亚铁溶液。
①硫酸浓度应选择(填字母序号)__________;
A.浓硫酸 B.10 moL·L-1硫酸
C.3 moL·L-1硫酸 D.任意浓度硫酸
②温度宜控制在________,加热的同时需适当补充水,原因是___________________;
③反应中应保持![]() _________ (填“<”“>”或“=”) 1。
_________ (填“<”“>”或“=”) 1。
(3)亚铁盐在空气中易被氧化,但形成复盐可稳定存在,如“摩尔盐”,即(NH4)2SO4·FeSO4·6H2O(硫酸亚铁铵),就是在硫酸亚铁溶液中加入少量稀硫酸溶液,再加入饱和硫酸铵溶液,经过_______、_______、_______、_______等一系列操作后所得。
【答案】 倾析 C 60 ℃左右 防止硫酸亚铁晶体析出 > 蒸发浓缩 冷却结晶 滤洗涤 过自然干燥
【解析】(1)由于Fe屑沉在容器的底部,溶液在上部,所以分离出液体的方法通常不用过滤,使用的操作是倾析法;(2)在室温下,Fe在浓硫酸中会发生钝化现象,在10moL/L硫酸中容易发生氧化还原反应产生硫酸铁和SO2和水;由于FeSO4在60℃左右溶解度最大,所以温度宜控制在60℃左右;为防止硫酸亚铁晶体析出,加热的同时需适当补充水,为了防止在加热的过程中Fe2+被氧化为Fe3+,Fe粉应该稍微过量一些;(3)稀硫酸的作用是为了抑制Fe2+、NH4+的水解,防止产物不纯。
(1)首先,将铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑.此步骤中,由于Fe屑沉在容器的底部,溶液在上部,所以分离出液体的方法通常不用过滤,使用的操作是倾析法;(2)在室温下,Fe在浓硫酸中会发生钝化现象.在10moL/L硫酸中容易发生氧化还原反应产生硫酸铁和SO2和水,不能得到硫酸亚铁,所以要用3moL/L硫酸.由于FeSO4在60℃左右溶解度最大,所以温度宜控制在60℃左右.为防止硫酸亚铁晶体析出,加热的同时需适当补充水.为了防止在加热的过程中Fe2+被氧化为Fe3+,Fe粉应该稍微过量一些,所以反应中应保持![]() >1;(3)在制取摩尔盐如硫酸亚铁铵[(NH4)2SO4FeSO46H2O]的过程,就是在FeSO4溶液中加入少量稀H2SO4溶液,再加入饱和(NH4)2SO4溶液,经过蒸发浓缩、冷却结晶、过滤等一系列操作后所得.过程中稀硫酸的作用是为了抑制Fe2+、NH4+的水解,防止产物不纯。
>1;(3)在制取摩尔盐如硫酸亚铁铵[(NH4)2SO4FeSO46H2O]的过程,就是在FeSO4溶液中加入少量稀H2SO4溶液,再加入饱和(NH4)2SO4溶液,经过蒸发浓缩、冷却结晶、过滤等一系列操作后所得.过程中稀硫酸的作用是为了抑制Fe2+、NH4+的水解,防止产物不纯。


科目:高中化学 来源: 题型:
【题目】下面图(1)和图(2)是A、B两种物质的核磁共振氢谱。已知A、B两种物质都是烃类,都含有6个氢原子。请根据图(1)和图(2)两种物质的核磁共振氢谱图选择出可能属于图(1)和图(2)的两种物质 ( )
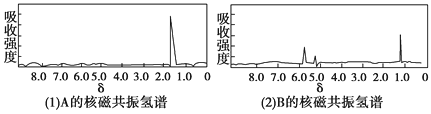
A. A是C3H6;B是C3H6 B. A是C6H6;B是C4H10
C. A是C3H8;B是C6H6 D. A是C3H6;B是C2H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是新型的汽车动力燃料。工业上可通过H2和CO化合制备甲醇,该反应的热化学方程式为:2H2(g)+CO(g) ![]() CH3OH(g) △H=-116kJ/mol
CH3OH(g) △H=-116kJ/mol
(1)已知:CO和H2的燃烧热分别为283kJ/mol、286kJ/mol 。1mol甲醇气体完全燃烧生成CO2和液态水的热化学方程式为_________________________________。
(2)下列措施中有利于提高2H2(g)+CO(g)![]() CH3OH(g)反应速率及原料平衡转化率的是_____(填标号)。
CH3OH(g)反应速率及原料平衡转化率的是_____(填标号)。
A.分离出CH3OH B.升高温度 C.增大压强 D.加入合适的催化剂
(3)在容积为2L的恒容容器中,分别在230℃、250℃、270℃下,改变H2和CO的起始组成比[(n(H2)/n(CO)],起始时CO的物质的量固定为1mol,实验结果如图所示:
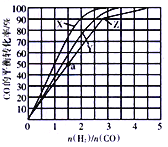
①Z曲线对应的温度是__________,判断的依据是________________。
②从图中可以得出的结论是(写两条)____________________、______________________。
(4)利用图中a点对应的数据,计算曲线Z对应温度下反应2H2(g)+CO(g)![]() CH3OH(g)的平衡常数为____________;若在a点向容器中再充入1.5molCH3OH和0.5molH2,则原平衡___移动(填“向正反应方向”或“向逆反应方向”或“不”)
CH3OH(g)的平衡常数为____________;若在a点向容器中再充入1.5molCH3OH和0.5molH2,则原平衡___移动(填“向正反应方向”或“向逆反应方向”或“不”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的说法正确的是( )
A.短周期是指第1、2周期
B.过渡元素全部是金属元素
C.IA族的元素全部是金属元素
D.元素周期表有8个副族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油脂的不饱和度可通过油脂与碘的加成反应测定,通常称为油脂的碘值。碘值越大,油脂的不饱和程度越高。碘值是指100g油脂所能吸收的I2的克数。
I.称取xg某油脂,加入含ymol I2的韦氏溶液( 韦氏溶液是碘值测定时使用的特殊试剂,含有CH3COOH),充分振荡;过量的I2用c mol/LNa2S2O3标准溶液滴定(淀粉作指示剂),消耗Na2S2O3溶液VmL(滴定反应为:2 Na2S2O3+ I2=Na2S4O6+2NaI)。回答下列问题:
(1)有关滴定的下列说法正确的是________(填标号)。
A.标准Na2S2O3溶液应盛装在碱式滴定管中
B.滴定时眼睛只要注视滴定管中溶液体积的变化
C.滴定到溶液由无色变蓝色时应该立即停止滴定
D.同样的滴定应重复2-3次,取几次滴定所用溶液的平均值计算滴定结果
(2)该油脂的碘值为___g(列式表示)。
(3)用该测定方法测定的碘值需要用相关的实验校正,因为所测得的碘值总比实际碘值低,原因是_____________________________________________。
II.现要从上述测定碘值实验后的含碘废液中回收碘单质(废液中含有H2O、油脂、I2、I-)。设计如图一所示的实验过程:

(4)为了将含碘废液中的I2完全转化为I-而进入水层,向含碘度液中加入了稍过量的A溶液,则A应该具有___________性。
(5)将操作①所得溶液放入图二所示的三颈烧瓶中,并用盐酸调至pH约为2,再缓慢通入适量Cl2,使其在30~40℃反应。反应要控制在30~40℃的原因是________________;Cl2不能过量,因为过量的Cl2将I2氧化为IO3-,写出该反应的离子方程式___________________________。

(6)操作②包含多步操作,将在三颈烧瓶中反应完全后的溶液经过操作②获得碘单质,在操作②中必须用列下列所示的部分仪器或装置,这些仪器和装置是________________(填标号)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以甲烷为原料合成甲醇的反应如下:
反应I:CH4(g) + CO2(g) ![]() 2CO(g) + 2H2(g) △H1= +247 kJ/mol
2CO(g) + 2H2(g) △H1= +247 kJ/mol
反应II:CO(g) + 2H2(g)![]() CH3OH(g) △H2=-90kJ/mol
CH3OH(g) △H2=-90kJ/mol
已知: T1℃时,反应II 的平衡常数数值为100;T2℃时,反应II 在密闭容器中达到平衡,测得CO、H2、CH3OH的物质的量浓度(mol/L)分别为0.05、0.1、0.1。下列说法中,正确的是
A. 反应I中,使用催化剂可以减小△H1,提高反应速率
B. 反应II 中,加热或加压均可提高原料气的平衡转化率
C. 由上述数据可判断反应II 的温度: T1> T2
D. CO(g)+CH3OH(g)![]() CH4(g) +CO2(g) △H= +157 kJ/mol
CH4(g) +CO2(g) △H= +157 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,下列叙述不是可逆反应A(g)+3B(g)2C(g)达到平衡标志的是( )
①C的生成速率与C的分解速率相等;
②单位时间生成amol A,同时生成3amolB;
③A、B、C的浓度不再变化;
④A、B、C的物质的量不再变化
A.②B.④C.③D.①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.碱性:LiOH>NaOH>KOH>RbOHB.金属性:Li>Na>K>Rb
C.原子半径:Li>Na>K>RbD.熔沸点:Li>Na>K>Rb
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com