
【题目】甲醇是新型的汽车动力燃料。工业上可通过H2和CO化合制备甲醇,该反应的热化学方程式为:2H2(g)+CO(g) ![]() CH3OH(g) △H=-116kJ/mol
CH3OH(g) △H=-116kJ/mol
(1)已知:CO和H2的燃烧热分别为283kJ/mol、286kJ/mol 。1mol甲醇气体完全燃烧生成CO2和液态水的热化学方程式为_________________________________。
(2)下列措施中有利于提高2H2(g)+CO(g)![]() CH3OH(g)反应速率及原料平衡转化率的是_____(填标号)。
CH3OH(g)反应速率及原料平衡转化率的是_____(填标号)。
A.分离出CH3OH B.升高温度 C.增大压强 D.加入合适的催化剂
(3)在容积为2L的恒容容器中,分别在230℃、250℃、270℃下,改变H2和CO的起始组成比[(n(H2)/n(CO)],起始时CO的物质的量固定为1mol,实验结果如图所示:
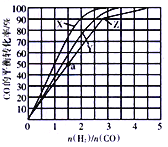
①Z曲线对应的温度是__________,判断的依据是________________。
②从图中可以得出的结论是(写两条)____________________、______________________。
(4)利用图中a点对应的数据,计算曲线Z对应温度下反应2H2(g)+CO(g)![]() CH3OH(g)的平衡常数为____________;若在a点向容器中再充入1.5molCH3OH和0.5molH2,则原平衡___移动(填“向正反应方向”或“向逆反应方向”或“不”)
CH3OH(g)的平衡常数为____________;若在a点向容器中再充入1.5molCH3OH和0.5molH2,则原平衡___移动(填“向正反应方向”或“向逆反应方向”或“不”)
【答案】 CH3OH(g)+1.5O2(g)=CO2(g)+2H2O(l) △H=-739kJ·mol-1 C 270℃ 该反应是放热反应,温度越高转化率越低,在n(H2)/n(CO)相同条件下,Z的CO转化率最低、故Z的温度为270℃ 相同温度下,CO的转化率随n(H2)/n(CO)增大而增大 在n(H2)/n(CO)相同条件下,温度越低CO的转化率越高或温度越高CO的转化率越低 16或16(mol/L)-2 不
【解析】试题分析:(1)根据盖斯定律计算甲醇的燃烧热;(2)根据影响反应速率和平衡移动的因素分析;(3) ①升高温度,平衡逆向移动,CO转化率降低;②分析同温下,CO转化率随n(H2)/n(CO)的变化情况;分析在n(H2)/n(CO)相同条件下,CO转化率随温度变化情况;(4)利用“三段式”计算平衡常数;根据Q与K的关系判断平衡移动方向;
解析:(l)CO和H2的燃烧热分别为283kJ/mol、286kJ/mol,即①CO(g)+0.5O2(g)=CO2(g) △H=-283kJ/mol;②2H2(g) +0.5O2(g)= 2H2O△H=- 572kJ/mol;③2H2(g)+CO(g) ![]() CH3OH(g) △H=-116kJ/mol,根据盖斯定律①+②-③得 CH3OH(g)+1.5O2(g)=CO2(g)+2H2O(l) △H=-739kJ·mol-1 ;(2) A.分离出CH3OH,浓度降低,速率减慢,故A错误; B.升高温度,反应速率加快,平衡逆向移动,原料转化率降低,故B错误; C.增大压强,反应速率加快,平衡正向移动,原料转化率提高,故C正确; D.加入合适的催化剂,平衡不移动,原料转化率不变,故D错误。(3) ①该反应是放热反应,温度越高转化率越低,在n(H2)/n(CO)相同条件下,Z的CO转化率最低、故Z的温度为270℃;②相同温度下,CO的转化率随n(H2)/n(CO)增大而增大;在n(H2)/n(CO)相同条件下,温度越低CO的转化率越高或温度越高CO的转化率越低;
CH3OH(g) △H=-116kJ/mol,根据盖斯定律①+②-③得 CH3OH(g)+1.5O2(g)=CO2(g)+2H2O(l) △H=-739kJ·mol-1 ;(2) A.分离出CH3OH,浓度降低,速率减慢,故A错误; B.升高温度,反应速率加快,平衡逆向移动,原料转化率降低,故B错误; C.增大压强,反应速率加快,平衡正向移动,原料转化率提高,故C正确; D.加入合适的催化剂,平衡不移动,原料转化率不变,故D错误。(3) ①该反应是放热反应,温度越高转化率越低,在n(H2)/n(CO)相同条件下,Z的CO转化率最低、故Z的温度为270℃;②相同温度下,CO的转化率随n(H2)/n(CO)增大而增大;在n(H2)/n(CO)相同条件下,温度越低CO的转化率越高或温度越高CO的转化率越低;
(4) 
![]() ;若在a点向容器中再充入1.5molCH3OH和0.5molH2,则甲醇的浓度为1mol/L、氢气的浓度为0.5mol/L、一氧化碳的浓度为0.25mol/L; Q=
;若在a点向容器中再充入1.5molCH3OH和0.5molH2,则甲醇的浓度为1mol/L、氢气的浓度为0.5mol/L、一氧化碳的浓度为0.25mol/L; Q= ![]() ,所以平衡不移动;
,所以平衡不移动;


科目:高中化学 来源: 题型:
【题目】某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和反应速率的测定。将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡气体总浓度/mol·L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
(1)可以判断该分解反应已经达到平衡的是________。
A.2v(NH3)=v(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
E.单位时间内消耗1 molNH2COONH4 ,同时生成2mol NH3
F.密闭容器中混合气体的平均摩尔质量不变 G.容器内NH3与CO2的浓度之比为2∶1 H.6个N—H键断裂的同时,有2个C=O键形成
(2)根据表中数据,计算25.0 ℃时的分解平衡常数______________。
(3)取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0 ℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量________(填“增加”、“减少”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6).
(1)丙烷脱氢可得丙烯. 已知:C3H8(g)=CH4(g)+HC≡CH(g)+H2(g);△H1=+156.6kJmol﹣1
CH3CH=CH2(g)=CH4(g)+HC≡CH(g);△H2=+32.4kJmol﹣1
则相同条件下,反应C3H8(g)=CH3CH=CH2(g)+H2(g)的△H=kJmol﹣1
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2 , 负极通入丙烷,电解质是熔融碳酸盐.电池总反应方程式;放电时,CO32﹣移向电池的 (填“正”或“负”)极.
(3)碳氢化合物完全燃烧生成CO2和H2O.常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10﹣5 mol/L.若忽略水的电离及H2CO3的第二级电离,则H2CO3HCO3﹣+H+的平衡常数K1= . (已知:10﹣5.60=2.5×10﹣6)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化合物的说法正确的是
A. 干冰的主要成分是H2O B. 吸入CO可导致人体中毒
C. SO2可大量用于漂白食品 D. 小苏打的主要成份是Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水玻璃是建筑行业常用的粘合剂,并可用于木材防火和防腐处理。水玻璃为
A. CaSiO3固体 B. SiO2
C. Na2SiO3水溶液 D. H2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁盐、铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用,现用铁屑与硫酸反应制备硫酸亚铁。
已知:①4Fe2++O2+4H+===4Fe3++2H2O
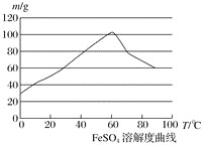
②硫酸亚铁在水中的溶解度如下图:
(1)首先,将铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。此步骤中,分离出液体的方法通常不用过滤,使用的操作是____________(填写操作名称)。
(2)向处理过的铁屑中加入适量的硫酸,在一定温度下使其反应到不再产生气体,趁热过滤,得硫酸亚铁溶液。
①硫酸浓度应选择(填字母序号)__________;
A.浓硫酸 B.10 moL·L-1硫酸
C.3 moL·L-1硫酸 D.任意浓度硫酸
②温度宜控制在________,加热的同时需适当补充水,原因是___________________;
③反应中应保持![]() _________ (填“<”“>”或“=”) 1。
_________ (填“<”“>”或“=”) 1。
(3)亚铁盐在空气中易被氧化,但形成复盐可稳定存在,如“摩尔盐”,即(NH4)2SO4·FeSO4·6H2O(硫酸亚铁铵),就是在硫酸亚铁溶液中加入少量稀硫酸溶液,再加入饱和硫酸铵溶液,经过_______、_______、_______、_______等一系列操作后所得。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知还原性:Fe2+>Br-。向100mLFeBr2溶液中通入3.36L(标准状况)Cl2,反应后的溶液中Cl-和Br-的物质的量浓度相等,则原溶液中FeBr2的物质的量浓度为( )
A. 2 mol·L-1 B. 1.5 mol·L-1 C. 1 mol·L-1 D. 0.75 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com