
【题目】某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和反应速率的测定。将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡气体总浓度/mol·L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
(1)可以判断该分解反应已经达到平衡的是________。
A.2v(NH3)=v(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
E.单位时间内消耗1 molNH2COONH4 ,同时生成2mol NH3
F.密闭容器中混合气体的平均摩尔质量不变 G.容器内NH3与CO2的浓度之比为2∶1 H.6个N—H键断裂的同时,有2个C=O键形成
(2)根据表中数据,计算25.0 ℃时的分解平衡常数______________。
(3)取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0 ℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量________(填“增加”、“减少”或“不变”)
【答案】 BCH K=c2(NH3)·c(CO2)=(![]() c)2·(
c)2·(![]() c)=
c)=![]() ×(4.8×10-3 mol·L-1)3≈1.6×10-8(mol·L-1)3 增加
×(4.8×10-3 mol·L-1)3≈1.6×10-8(mol·L-1)3 增加
【解析】(1)根据达到平衡状态的特征:各组分浓度不再变化,正逆反应速率相等进行判断;
(2)根据化学平衡常数的表达式进行计算;
(3)根据平衡移动原理判断。
(1)A、不能表示正、逆反应速率相等,不能判断化学反应是否达到平衡,故A错误;
B、由于正反应方向气体分子数增大,则密闭容器中压强不变,反应达到平衡,故B正确;
C、恒容,若平衡发生移动,则混合气体密度发生改变,故C正确;
D、反应物是固体,NH3的体积分数始终为![]() ,故D错误;
,故D错误;
E. 由方程式可知,单位时间内消耗1 molNH2COONH4 一定生成2mol NH3,不能判断化学反应是否达到平衡,故E错误;
F.混合气体中氨气和二氧化碳体积比为2:1,组成一定,平均摩尔质量始终不变,不能判断化学反应是否达到平衡,故F错误;
G.容器内NH3与CO2的浓度之比为2∶1 是定值,不能判断化学反应是否达到平衡,故G错误;
H.6个N—H键断裂的同时有2个C=O键形成,说明正、逆反应速率相等,化学反应已达到平衡,故H正确。
因此,本题答案为:BCH;
(2)需将25 ℃的总浓度转化为NH3和CO2的浓度:c(NH3)=![]() ×4.8×10-3mol·L-1=3.2×10-3mol·L-1,c(CO2)=
×4.8×10-3mol·L-1=3.2×10-3mol·L-1,c(CO2)=![]() ×4.8×10-3mol·L-1=1.6×10-3mol·L-1,K=(3.2×10-3)2×1.6×10-3≈1.6×10-8;
×4.8×10-3mol·L-1=1.6×10-3mol·L-1,K=(3.2×10-3)2×1.6×10-3≈1.6×10-8;
(3)压缩容器体积,增大了压强,平衡向着逆向移动,氨基甲酸铵固体的质量增加,故答案为:增加。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。请回答下列问题:
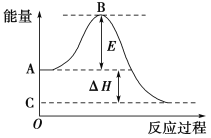
(1)图中A点表示:___________, B点表示:__________,E的大小对该反应的反应热________(填“有”或“无”)影响。
(2)图中ΔH=________kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1mol氢气和氧气完全燃烧生成水蒸气放出241.8千焦热量,下列热化学方程式正确的是
A. 2H2(g)+O2(g)→2H2O(g)+241.8kJ
B. H2(g)+1/2O2(g)→H2O(s)+241.8 kJ
C. H2(g)+1/2O2(g)→H2O(g)-241.8 kJ
D. H2O(g)→H2(g)+1/2O2(g)-241.8 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝、铁是常见的两种金属,它们的单质及化合物在生活生产中处处可见。
(1)过量的铁和稀硝酸发生反应,产物是Fe(NO3)2和NO,写出该反应的化学方程式___________。
(2)实验室配制FeSO4溶液时,如果没有隔绝空气,FeSO4会被氧化为_______(填写化学式)。在该溶液中加入___________试剂,看到_____________________现象,证明溶液变质。
(3)KAl(SO4)2·12H2O俗称明矾,常用作净水剂,请述其原因并写出有关的离子方程式____________________。
(4)已知Ba(AlO2)2可溶于水,下图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系。
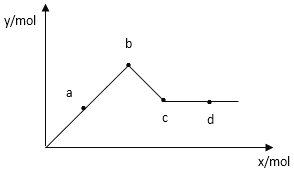
由图可知c点的沉淀是________(填化学式),已知a-b时存在的沉淀是Al(OH)3和BaSO4,两者的物质的量:________比________多。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生理盐水是指质量分数为0.9﹪的NaCl溶液。下列有关该溶液说法正确的是
A. 100g溶液中含有0.9 g NaCl B. 100 g水中含有0.9 g NaCl
C. 100g溶液中含有0.9 mol NaCl D. 100 g水中含有0.9 mol NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有可逆反应Fe(s)+CO2(g)FeO(s)+CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2,下列叙述正确的是( )
A.该反应达到平衡状态时c(CO2)=c(CO)
B.该反应的正反应是放热反应
C.若起始时把Fe和2.0mol CO2放入体积固定为1 L的密闭容器中,某温度时达到平衡,此时容器中CO的浓度为1.0 mol/L,则该温度下上述反应的平衡常数K=1.0
D.若该反应在体积固定的密闭容器中进行,在恒温下达到平衡状态,再通入CO反应混合气体中CO2的物质的量分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面图(1)和图(2)是A、B两种物质的核磁共振氢谱。已知A、B两种物质都是烃类,都含有6个氢原子。请根据图(1)和图(2)两种物质的核磁共振氢谱图选择出可能属于图(1)和图(2)的两种物质 ( )
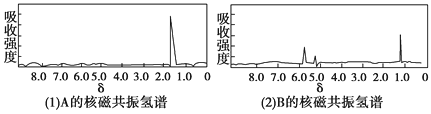
A. A是C3H6;B是C3H6 B. A是C6H6;B是C4H10
C. A是C3H8;B是C6H6 D. A是C3H6;B是C2H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是新型的汽车动力燃料。工业上可通过H2和CO化合制备甲醇,该反应的热化学方程式为:2H2(g)+CO(g) ![]() CH3OH(g) △H=-116kJ/mol
CH3OH(g) △H=-116kJ/mol
(1)已知:CO和H2的燃烧热分别为283kJ/mol、286kJ/mol 。1mol甲醇气体完全燃烧生成CO2和液态水的热化学方程式为_________________________________。
(2)下列措施中有利于提高2H2(g)+CO(g)![]() CH3OH(g)反应速率及原料平衡转化率的是_____(填标号)。
CH3OH(g)反应速率及原料平衡转化率的是_____(填标号)。
A.分离出CH3OH B.升高温度 C.增大压强 D.加入合适的催化剂
(3)在容积为2L的恒容容器中,分别在230℃、250℃、270℃下,改变H2和CO的起始组成比[(n(H2)/n(CO)],起始时CO的物质的量固定为1mol,实验结果如图所示:
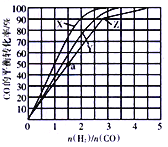
①Z曲线对应的温度是__________,判断的依据是________________。
②从图中可以得出的结论是(写两条)____________________、______________________。
(4)利用图中a点对应的数据,计算曲线Z对应温度下反应2H2(g)+CO(g)![]() CH3OH(g)的平衡常数为____________;若在a点向容器中再充入1.5molCH3OH和0.5molH2,则原平衡___移动(填“向正反应方向”或“向逆反应方向”或“不”)
CH3OH(g)的平衡常数为____________;若在a点向容器中再充入1.5molCH3OH和0.5molH2,则原平衡___移动(填“向正反应方向”或“向逆反应方向”或“不”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com