
【题目】组成东北虎的最基本元素是( )
A. C B. O C. H D. N
科目:高中化学 来源: 题型:
【题目】1838年李比希提出了“基团”的定义,从此,有机化学中“基团”概念就确定了,下列有机基团的表达式不正确的是( )
A. 甲基-CH3 B.羟基-OH- C. 醛基-CHO D.羧基-COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用X表示原子:
(1)中性原子的中子数:N=________。
(2)阴离子的中子数:AXn-共有x个电子,则N=________。
(3)中性分子中子数:12C18O2分子中,N=________。
(4)A2-原子核内有x个中子,其质量数为m,则n gA2-所含电子的物质的量为________mol。
(5)某元素的同位素X,其氯化物XCl2。1.11 g溶于水制成溶液后,加入1 mol/L的AgNO3溶液20 mL恰好完全反应。若这种同位素原子核内有20个中子,则:X元素在周期表中的位置_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298 K时,各反应的平衡常数如下:
①N2(g)+O2(g)![]() 2NO(g),K=1×10-30;
2NO(g),K=1×10-30;
②2H2(g)+O2(g)![]() 2H2O(g),K=2×1081;
2H2O(g),K=2×1081;
③2CO2(g)![]() 2CO(g)+O2(g),K=4×10-92
2CO(g)+O2(g),K=4×10-92
则常温下,NO、H2O、CO2这三个化合物分解放氧的倾向最大的是( )
A.① B.② C.③ D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示的原电池,下列说法正确的是( )

A. 电子从锌电极通过导线流向铜电极,再流回锌电极,形成闭合电路
B. 盐桥中的阳离子向硫酸铜溶液中迁移
C. 锌电极发生还原反应
D. 铜电极上发生的电极反应为2H++2e-===H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2 -e— + OH- = NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解法制取有广泛用途的Na2FeO4,同时获取氢气:Fe+2H2O+2OH-![]() FeO42-+3H2↑,工作原理如图(a)所示,电解质溶液为氢氧化钠溶液,若氢氧化钠溶液浓度过高,铁电极区会产生红褐色色物质。C(Na2FeO4)随初始C(NaOH)的变化如图(b)所示。已知Na2FeO4只在强碱性条件下稳定,易被H2还原。下列说法不正确的是
FeO42-+3H2↑,工作原理如图(a)所示,电解质溶液为氢氧化钠溶液,若氢氧化钠溶液浓度过高,铁电极区会产生红褐色色物质。C(Na2FeO4)随初始C(NaOH)的变化如图(b)所示。已知Na2FeO4只在强碱性条件下稳定,易被H2还原。下列说法不正确的是
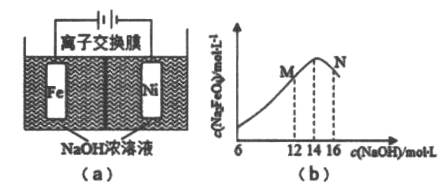
A. 电解一段时间后,阳极室c(OH-)降低
B. 电路中经过0.2mol电子时,阴极室生成H2 2.24L(标准状况)
C. M点C(Na2FeO4)低于最高值的原因是铁电极上有Fe(OH)3生成
D. 阳极的电极反应:Fe一6e-+8OH-===FeO42-+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和反应速率的测定。将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡气体总浓度/mol·L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
(1)可以判断该分解反应已经达到平衡的是________。
A.2v(NH3)=v(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
E.单位时间内消耗1 molNH2COONH4 ,同时生成2mol NH3
F.密闭容器中混合气体的平均摩尔质量不变 G.容器内NH3与CO2的浓度之比为2∶1 H.6个N—H键断裂的同时,有2个C=O键形成
(2)根据表中数据,计算25.0 ℃时的分解平衡常数______________。
(3)取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0 ℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量________(填“增加”、“减少”或“不变”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com