
����Ŀ����X��ʾԭ�ӣ�
(1)����ԭ�ӵ���������N��________��
(2)�����ӵ���������AXn������x�����ӣ���N��________��
(3)���Է�����������12C18O2�����У�N��________��
(4)A2��ԭ�Ӻ�����x�����ӣ���������Ϊm����n gA2���������ӵ����ʵ���Ϊ________mol��
(5)ijԪ�ص�ͬλ��X�����Ȼ���XCl2��1.11 g����ˮ�Ƴ���Һ����1 mol/L��AgNO3��Һ20 mLǡ����ȫ��Ӧ��������ͬλ��ԭ�Ӻ�����20�����ӣ���XԪ�������ڱ��е�λ��_____________________________��
���𰸡� A��Z���� A��x��n 26 n(m-x+2)/m �������ڵڢ�A��
����������1��������������=������+�����������������������2��������������=������+�����������Լ����������У����˵����=������=���������-�����������������ý������3��������������=������+���������Ĺ�ϵ������12C18O2���ӵ�ԭ�ӣ�����÷��ӵ�����������4�������n gA2-�����ʵ������ٸ�����������=������+�������������������У����˵����=������=���������+����������������������ӵ����ʵ�������5���ȸ��ݻ�ѧ��Ӧ��ϵ���X�����ԭ���������Ӷ�ȷ��X�����������ٸ�����������=������+�������������������������ȷ��XԪ�������ڱ��е�λ�á�
��1������������(A)��������(Z)+������(N)������������(N)��A-Z��
��2��������AXn-��x�����ӣ���Xԭ�ӵ�������=���������-�����������x-n������������(A)��������+������(N)������������(N)��A-(x-n)=A-x+n��
��3��12C��������Ϊ��12-6=6��18O��������Ϊ��18-8=10������12C18O2��������Ϊ6+10��2=26��
��4��n gA2-�����ʵ���Ϊ��![]() mol��A2-��������Ϊ��m-x��������Ϊ��m-x+2������n gA2-���������������ʵ���Ϊ
mol��A2-��������Ϊ��m-x��������Ϊ��m-x+2������n gA2-���������������ʵ���Ϊ![]() (m-x+2)mol��
(m-x+2)mol��
��5���������ⷴӦ��ѧ����ʽΪ��XCl2��2AgNO3=2AgCl����X(NO3)2����Ӧ����AgNO3�����ʵ���Ϊ��1 mol/L��0.02 L��0.02 mol������XCl2�����ʵ���Ϊ0.01 mol����M(XCl2)��=111 g/mol����XCl2����Է�������Ϊ111��X�����ԭ������Ϊ111-36.5��2=40������X��������Ϊ40��������Ϊ40-20��20��Ϊ��Ԫ�أ���X��Ԫ�����ڱ��е�λ��Ϊ���������ڵڢ�A����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʳ����������һ�������ʳ��ԭҺ�����������������λ��gL��1��g/100mL�����ұ��涨����ʳ�����Ậ�����õ���3.5g/100mL��
��1�������ζ����ⶨijʳ����Ʒ�е�������ʱ������˵������ȷ������˫ѡ����
A.��NaOH��Һ�ζ�ʱ��Ӧ�����ӷ���ʽΪH++OH��=H2O
B.ʳ����Ʒͨ����ҪԤ��ϡ��һ���������ٽ��еζ�
C.��NaOH��Һ�ζ�ʱ����ʹ�÷�̪�������ָʾ��
D.�������Ʒ�����ʵ���Ũ��Ϊ0.75molL��1 �� ����������Ϊ45gL��1
��2��ijͬѧ��ϸ�۲��ʳ����Ʒ�ı�ǩ���������л�������ΪʳƷ���Ӽ��ı������ƣ�C6H5COONa����������������֤�����뱽�����Ʋ��ᷢ�����ӻ�����Ӧ���������һ���¶��´����뱽����� ��
A.pH
B.�����
C.���볣��
D.�ܽ��
��3�������£���0.1000molL��1 NaOH��Һ�ֱ�ζ�20.00mL 0.1000molL��1 HCl��Һ��20.00mL 0.1000molL��1 CH3COOH��Һ���õ������ζ����ߣ���ͼ��ʾ�� 
�ٵζ�������Һ�����������ͼ1����ͼ2�������ζ�������a= mL��
��E��pH��8��ԭ���ǣ������ӷ���ʽ��ʾ���� ��
��4���ⶨʳ��������ʵ���У�����NaOH��Һ��ϡ��ʳ�����õ�����ˮ������У�Ŀ���� ��
��5��ʵ��ʱ����ȡʳ����Ʒ10mL��100mL����ƿ�ж��ݣ���ȡ���ݺ����Һ20mL����ƿ�У�����1��2��ָʾ������Ũ��Ϊc molL��1��NaOH����Һ�ζ���ƽ�вⶨ���Σ�����NaOH��Һ��ƽ�����ΪV mL����ԭʳ����Ʒ��������= g/100mL��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(SO2Cl2)��һ����Ҫ�Ļ����Լ����Ȼ����Ǻϳ�������(SO2Cl2)�ij��÷�����ʵ���Һϳ������ȵ�ʵ��װ������ͼ��ʾ(���ּг�װ��δ����)��

��֪:��SO2(g)+Cl2(g)=SO2Cl2 ��H=-97.3kJ/mol��
�ڳ�����������Ϊ��ɫҺ�壬�۵�-54.1�棬�е�69.1�棬�ڳ�ʪ�����С����̡���
��100�����ϻ�ʱ���������ȶ��ֽ⣬���ɶ��������������
�ش���������:
(1)�������ڳ�ʪ�����С����̡���ԭ��___________(�û�ѧ����ʽ��ʾ)��
(2)װ��B��ʢ�ŵ��Լ���________������D������Ϊ________��
(3)װ��E��������_____��E������ˮ�������____(�a����b��)������װ�ô��ڵ�һ��ȱ����_______��
(4)��װ��A����������1.12L(������ɱ�״��)ʱ�������ȵIJ���Ϊ44%�������յõ�������������_______g��
(5)�Ȼ���(ClSO3H)���ȷֽ⣬Ҳ���Ƶ�������������һ�����ʣ��÷�Ӧ�Ļ�ѧ����ʽΪ___________________���������ֲ���ķ�����______________��
(6)�����ȵĹ�ҵƷ�г������������ᣬ�������ʵ����֤���к�������(д��ʵ�鷽�������ʵ��������д������ʵ�����________����ѡ�Լ�:ϡ���ᡢϡ���ᡢBaCl2��Һ������ˮ��ʯ����Һ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���˹�������ü�ӵ绯ѧ������ȥ��л�����е����أ�ԭ����ͼ�� 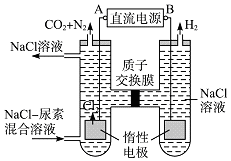
��1����Դ�ĸ���Ϊ���A����B������
��2���������з����ķ�Ӧ����Ϊ�� �� ��
��3������������������Һ��pH����ǰ��Ƚ������������С�����䡱�������������ռ�������13.44L����״���������ȥ����������=g������������ܽ⣩��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������л�Ϊͬ���칹�����
A.1H2��2H2��3H2B.����ɱ�C.���ʯ��ʯīD.CH3CH2OH��CH3OCH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йص������Һ��˵����ȷ���ǣ�������
A.��0.1molL��1 CH3COOH��Һ�м�������ˮ����Һ�� ![]() ��С
��С
B.��CH3COONa��Һ��20��������30�棬��Һ�� ![]() ����
����
C.�������м��백ˮ�����ԣ���Һ�� ![]() ��1
��1
D.��AgCl��AgBr�ı�����Һ�м�������AgNO3 �� ��Һ�� ![]() ����
����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ѹǿ�仯����ʹ���л�ѧ��Ӧ��ƽ�ⷢ���ƶ����� ( ��
A. H2(��)��I2(��) ![]() 2HI(��)
2HI(��)
B. 3H2(��)��N2(��) ![]() 2NH3(��)
2NH3(��)
C. 2SO2(��)��O2(��) ![]() 2SO3(��)
2SO3(��)
D. C(��)��CO2(��) ![]() 2CO(��)
2CO(��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijģ�����˹���Ҷ���绯ѧʵ��װ������ͼ��ʾ����װ���ܽ�H2O��CO2ת��ΪO2��ȼ��(C3H8O)������˵����ȷ����(����)

A. ��װ�ý���ѧ��ת��Ϊ���ܺ͵���
B. ��װ�ù���ʱ��H����a������b����Ǩ��
C. ÿ����1 mol O2��Լ��29 g CO2����ԭ
D. a�缫�ķ�ӦΪ��3CO2��18H����18e��===C3H8O��5H2O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com