
【题目】下列各组物质中互为同分异构体的是
A.1H2、2H2与3H2B.冰与干冰C.金刚石和石墨D.CH3CH2OH与CH3OCH3
科目:高中化学 来源: 题型:
【题目】砷元素广泛存在于自然界,砷与其化合物被运用在农药、除草剂、杀虫剂等。
(1)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据图1写出As2O3转化为As2O5的热化学方程式__________________________________。

(2)砷酸钠具有氧化性,298K时,在100mL烧杯中加入10mL0.1 mol/L Na3AsO4溶液、20mL0.1 mol/L KI溶液和20mL0.05mol/L硫酸溶液,发生下列反应:AsO43-(无色)+12(浅黄色)+H2O △H。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
①升高温度,溶液中AsO43-的平衡转化率减小,则该反应的△H________0(填“大于”“小于”或“等于”)。
②0~10min内,I的反应速率v(Iˉ)= ____________。
③下列情况表明上述可逆反应达到平衡状态的是_______(填字母代号)。
a.c(AsO33-)+c(AsO42-)不再变化 b.溶液颜色保持不再变化
C.c(AsO33-)与c(AsO42-)的比值保持不再变化 d.I的生成速率等于I2的生成速率
④在该条件下,上述反应平衡常数的表达式K=______________。
(3)利用(2)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
①将试样02000g溶于NaOH溶液,得到含AO33-和AsO43-的混合溶液。
②上述混合液用0.02500 mol·L-1的I2溶液滴定,用淀粉试液做指示剂,当________________,则滴定达到终点。重复滴定3次,平均消耗I2溶液40.00mL。则试样中As2O5的质量分数是_________(保留四位有效数字)。若滴定终点时,仰视读数,则所测结果_________ (填“偏低”,“偏高”,“无影响”)。
【答案】 略 略 略 略 略 略 略 略
【解析】(1). 由图1可知,As2O3(s)和O2(g)反应转化为As2O5(s)的△H=-(914.6-619.2)kJ/mol=-295.4kJ/mol,则热化学方程式为:As2O3(s)+O2(g)=As2O5(s) △H=-295.4kJ/mol,故答案为:As2O3(s)+O2(g)=As2O5(s) △H=-295.4kJ/mol;
(2). ①. 升高温变,溶液中AsO43-的平衡转化率减小,说明升高温度,平衡逆向移动,该反应为放热反应,则△H<0,故答案为:小于;
②. 在0~10min 内,I2的浓度从0变为0.015mol/L,由反应方程式可知,I-减少了0.03mol/L,则0~10min内,用I-表示的反应速率v(I-)=0.03mol/L÷10min=0.003mol/(L·min),故答案为:0.003mol/(L·min);
③. a. 根据物料守恒关系可知,溶液中的c(AsO33-)+c(AsO43-)始终不变,所以c(AsO33-)+c(AsO43-)不再变化,不能说明反应达到平衡状态,故a错误;b. 溶液颜色不再变化,说明各物质的浓度不再改变,反应达到平衡状态,故b正确;c. c(AsO33-)与c(AsO43-)的比值不再变化,说明正逆反应速率相等,反应达到平衡状态,故c正确;d. I-的生成速率等于I2的生成速率,正逆反应速率不相等,说明反应没有达到平衡状态,故d错误;答案选:bc;
④. 由反应方程式可知,在该条件下,反应平衡常数的表达式K=![]() ,故答案为:
,故答案为:![]() ;
;
(3). ①. 用0.02500mol/L的I2溶液滴定含AsO33-和AsO43-的混合溶液,当滴入最后一滴标准液时,溶液由无色变蓝色,且30s内不恢复,即为滴定终点,上述混合液用0.02500mol/L的I2溶液滴定,重复滴定3次,平均消耗I2溶液40.0mL,根据As2O5+6OH=2AsO43+3H2O、AsO33-+I2+H2O ![]() AsO43-+2I-+2H+可知:
AsO43-+2I-+2H+可知:
1 1
n 0.02500mol/L×0.04L,n(AsO33-)= 0.001mol,则试样中As2O5的质量分数是![]() ×100%=50.50%,若滴定终点时仰视读数,会使读取的标准液体积偏大,n(AsO33-)偏大,则As2O5的质量分数偏小,所测结果偏低,故答案为:滴入最后一滴标准液,溶液由无色变蓝色,且30s内不恢复;50.50%;偏低。
×100%=50.50%,若滴定终点时仰视读数,会使读取的标准液体积偏大,n(AsO33-)偏大,则As2O5的质量分数偏小,所测结果偏低,故答案为:滴入最后一滴标准液,溶液由无色变蓝色,且30s内不恢复;50.50%;偏低。
【题型】综合题
结束】
11
【题目】元素周期表中第四周期元素有许多重要用途。
I.研究发现,钒元素的某种配合物可增强胰岛素降糖作用,它是电中性分子,结构如图1。
(1) 基态V元素的价层电子轨道表示式为___________,分子中非金属元素电负性由大到小的顺序为______________。
(2) 分子中采取sp2杂化的原子有_________,1mol 分子中含有配位键的数目是______。
(3) 该物质的晶体中除配位键外,所含微粒间作用力的类型还有______ (填序号)。
a. 金属键 b.极性键 c.非极性键 d.范德华力 e. 氢键
II.Fe 与C、Mn等元素可形成多种不同性能的合金。
(4) 图2-甲是Fe的一种晶胞,晶胞中Fe 的堆积方式为________,己知该晶体的密度为ρg·cm-3,用NA表示阿伏加德罗常数的值,则该晶胞的边长为__________cm。
(5) 图2-乙是Fe-C-Mn 合金(晶体有缺陷)的一种晶胞,则与C原子等距紧邻Fe 的个数为___,该合金的化学式为__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】RNA 水解后,得到的化学物质是
A .氨基酸、葡萄糖、碱基
B .氨基酸、核糖、核苷酸
C .核糖、碱基、磷酸
D .脱氧核糖、碱基、磷酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以天然气为原料合成甲醇。有关热化学方程式如下:
①2CH4(g)+O2(g)![]() 2CO(g)+4H2(g) ΔH1=-70.8 kJ·mol-1
2CO(g)+4H2(g) ΔH1=-70.8 kJ·mol-1
②CO(g)+2H2(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
③2CH4(g)+O2(g)![]() 2CH3OH(g) ΔH3=-251.0 kJ·mol-1
2CH3OH(g) ΔH3=-251.0 kJ·mol-1
(1)ΔH2=____kJ·mol-1。
(2)在体积可变的密闭容器中投入1 mol CO和2 mol H2,在不同条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图1所示。
CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图1所示。

①M点时,H2的转化率为____;压强:p1____(填“>”“<”或“=”)p2。
②反应速率:N点v正(CO)____(填“>”“<”或“=”)M点v逆(CO)。
③若压强为p1、在1 L恒容密闭容器中进行上述反应(起始投料不变),在不同温度下上述反应的平衡常数的对数(lg K)如图2所示。则温度为506 K时,平衡常数K=____(保留三位小数),B、C、D、E四点中能正确表示该反应的lg K与T的关系的点为____。
④在2 L恒容密闭容器中充入a(a>0) mol H2、2 mol CO和7.4 mol CH3OH(g),在506 K下进行上述反应。为了使该反应逆向进行,a的范围为________。
(3)某甲醇-空气燃料电池以KOH溶液为电解质溶液。当KOH全部转化成KHCO3时停止放电,写出此时负极的电极反应式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用X表示原子:
(1)中性原子的中子数:N=________。
(2)阴离子的中子数:AXn-共有x个电子,则N=________。
(3)中性分子中子数:12C18O2分子中,N=________。
(4)A2-原子核内有x个中子,其质量数为m,则n gA2-所含电子的物质的量为________mol。
(5)某元素的同位素X,其氯化物XCl2。1.11 g溶于水制成溶液后,加入1 mol/L的AgNO3溶液20 mL恰好完全反应。若这种同位素原子核内有20个中子,则:X元素在周期表中的位置_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。

回答下列问题:
(1)元素b在元素周期表中的位置是________。
(2)元素e的负一价离子的结构示意图为________,与元素g的简单离子,二者的离子半径大小顺序为________。(用离子符号表示)
(3)元素i的气态氢化物比元素e的气态氢化物________(填“稳定”或“不稳定”)。
(4)元素i的单质溶于元素f的最高价氧化物对应的水化物中,可生成具有漂白作用的一种盐,该盐的电子式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数,下列叙述正确的是( )
A.2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA
B.0.5mol C2H6分子中所含C﹣H共价键数为2NA
C.标准状况下,22.4L乙醇完全燃烧所耗的氧气分子数为3NA
D.1mol甲基﹣CH3所含的电子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃组成的混合气体完全燃烧后所得到CO2和H2O的物质的量随混合烃总物质的量的变化如图所示.下列有关混合气体的说法正确的是( ) 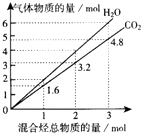
A.该混合气体中一定含有乙烯
B.该混合气体一定含有甲烷和乙炔
C.在110℃条件下,该混合气体与氧气混合,总混合气燃烧前后体积不变
D.若混合气体由CH4和C2H4组成,则其体积比为1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“墙角数枝梅,凌寒独自开。遥知不是雪,为有暗香来。”诗人在远处能闻到梅花香味,表明
A. 分子很小 B. 分子可再分
C. 分子之间有间隙 D. 分子在不停地运动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com