
【题目】以天然气为原料合成甲醇。有关热化学方程式如下:
①2CH4(g)+O2(g)![]() 2CO(g)+4H2(g) ΔH1=-70.8 kJ·mol-1
2CO(g)+4H2(g) ΔH1=-70.8 kJ·mol-1
②CO(g)+2H2(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
③2CH4(g)+O2(g)![]() 2CH3OH(g) ΔH3=-251.0 kJ·mol-1
2CH3OH(g) ΔH3=-251.0 kJ·mol-1
(1)ΔH2=____kJ·mol-1。
(2)在体积可变的密闭容器中投入1 mol CO和2 mol H2,在不同条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图1所示。
CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图1所示。

①M点时,H2的转化率为____;压强:p1____(填“>”“<”或“=”)p2。
②反应速率:N点v正(CO)____(填“>”“<”或“=”)M点v逆(CO)。
③若压强为p1、在1 L恒容密闭容器中进行上述反应(起始投料不变),在不同温度下上述反应的平衡常数的对数(lg K)如图2所示。则温度为506 K时,平衡常数K=____(保留三位小数),B、C、D、E四点中能正确表示该反应的lg K与T的关系的点为____。
④在2 L恒容密闭容器中充入a(a>0) mol H2、2 mol CO和7.4 mol CH3OH(g),在506 K下进行上述反应。为了使该反应逆向进行,a的范围为________。
(3)某甲醇-空气燃料电池以KOH溶液为电解质溶液。当KOH全部转化成KHCO3时停止放电,写出此时负极的电极反应式________________________________。
【答案】 -90.1 25% > < 0.148 BE 0<a<10 CH3OH-6e-+7OH-![]() HCO3-+5H2O
HCO3-+5H2O
【解析】(1) ①2CH4(g)+O2(g)= 2CO(g)+4H2(g) ΔH1=-70.8 kJ·mol-1,③2CH4(g)+O2(g) ![]() 2CH3OH(g) ΔH3=-251.0 kJ·mol-1,根据盖斯定律,将(③-①)×
2CH3OH(g) ΔH3=-251.0 kJ·mol-1,根据盖斯定律,将(③-①)×![]() 得:CO(g)+2H2(g)
得:CO(g)+2H2(g) ![]() CH3OH(g)ΔH2=
CH3OH(g)ΔH2=![]() ×[(-251.0 kJ·mol-1)-(-70.8 kJ·mol-1)]= -90.1 kJ·mol-1,故答案为:-90.1;
×[(-251.0 kJ·mol-1)-(-70.8 kJ·mol-1)]= -90.1 kJ·mol-1,故答案为:-90.1;
(2)①根据图像,M点时,生成的甲醇为0.25mol,则反应的H2为0.5mol,H2的转化率=![]() ×100%=25%;根据反应方程式CO(g)+2H2(g)
×100%=25%;根据反应方程式CO(g)+2H2(g) ![]() CH3OH(g),增大压强,平衡正向移动,甲醇的物质的量增大,因此p1>p2,故答案为:25%;>;
CH3OH(g),增大压强,平衡正向移动,甲醇的物质的量增大,因此p1>p2,故答案为:25%;>;
②其他条件相同时,压强越大,反应速率越快,反应速率:N点v正(CO)<M点v逆(CO) ,故答案为:<;
③根据图像1,压强为p1时,平衡时甲醇为0.25mol,则CO为1mol-0.25mol=0.75mol,H2为2mol-0.25mol×2=1.5mol,平衡常数K= =0.148;该反应为放热反应,升高温度,平衡逆向移动,K减小,lg K减小,符合条件的点有BE,故答案为:0.148;BE;
=0.148;该反应为放热反应,升高温度,平衡逆向移动,K减小,lg K减小,符合条件的点有BE,故答案为:0.148;BE;
④为了使该反应逆向进行,需要满足Qc大于K,即 >
> ,因此a<10,故答案为:0<a<10;
,因此a<10,故答案为:0<a<10;
(3) 甲醇-空气燃料电池以KOH溶液为电解质溶液。当KOH全部转化成KHCO3时停止放电,此时负极上甲醇发生氧化反应生成HCO3-,电极反应式为CH3OH-6e-+7OH-= HCO3-+5H2O,故答案为:CH3OH-6e-+7OH-= HCO3-+5H2O。


科目:高中化学 来源: 题型:
【题目】下列有关金属的工业制法中,正确的是
A. 以海水为原料制得精盐,再电解精盐的水溶液制取钠
B. 用海水、石灰乳等为原料,经一系列过程制得氧化镁,用H2还原氧化镁制得镁
C. 以铁矿石、焦炭、空气、石灰石等为原料,通过反应产生的CO在高温下还原铁矿石制得铁
D. 从铝土矿中获得氧化铝再制得氯化铝固体,电解熔融的氯化铝得到铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Al、Fe、Cu 是重要的材料元素,在生产生活中有着广泛的应用。回答下列问题:
(1)基态Fe2+的核外电子排布式为[Ar]______,有__个未成对电子。
(2)氯化铝熔点为194℃,而氧化铝熔点为2050℃,二者熔点相差很大的原因是_____。
(3)已知Al 的第一电离能为578kJ/mol、第二电离能为1817 kJ/mol、第三电离能为2745 kJ/mol、第四电离能为11575 kJ/mol。请解释其第二电离能增幅较大的原因________。
(4)甲醇重整制氢反应中,铜基催化剂如CuO/SiO2具有重整温度低、催化选择性高的优点。Cu、Si、O元素电负性由大到小的顺序是____;SiO2中Si原子采取____杂化。
(5)一种铜的溴化物晶胞结构如图所示:该晶胞中铜的配位数是___,与溴紧邻的溴原子数目是________,由图中P点和Q点的原子坐标参数可确定R点的原子坐标参数为________;已知晶胞参数为apm,其密度为_______g/cm3 (列出计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是周期表中短周期的一部分,A、B、C三种元素原子核外的电子数之和等于B原子的质量数。B原子核内的质子数和中子数相等。下列叙述不正确的是( )
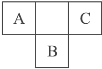
A. 三种元素的原子半径的大小顺序是B>C>A
B. A元素最高价氧化物对应的水化物具有强氧化性
C. B元素的氧化物、氢化物的水溶液都呈酸性
D. C元素是非金属性最强的元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com