
����Ŀ���п��淴ӦFe��s��+CO2��g��FeO��s��+CO��g������֪���¶�938Kʱ��ƽ�ⳣ��K=1.5����1173Kʱ��K=2.2������������ȷ���ǣ�������
A.�÷�Ӧ�ﵽƽ��״̬ʱc��CO2��=c��CO��
B.�÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ
C.����ʼʱ��Fe��2.0mol CO2��������̶�Ϊ1 L���ܱ������У�ij�¶�ʱ�ﵽƽ�⣬��ʱ������CO��Ũ��Ϊ1.0 mol/L������¶���������Ӧ��ƽ�ⳣ��K=1.0
D.���÷�Ӧ������̶����ܱ������н��У��ں����´ﵽƽ��״̬����ͨ��CO��Ӧ���������CO2�����ʵ�����������
���𰸡�C
���������⣺A��ƽ��ʱŨ�Ȳ�һ����ȣ�����ʼŨ�ȡ�ת�����йأ���A����
B������Ϣ��֪���¶�Խ�ߣ�KԽ����÷�ӦΪ���ȷ�Ӧ����B����
C���ﵽƽ�⣬��ʱ������CO��Ũ��Ϊ1.0 mol/L��c��CO2��=1mol/L����K= ![]() =
= ![]() =1.0����C��ȷ��
=1.0����C��ȷ��
D��������¶Ȳ��䣬��ͨ��CO��Ӧ��ѹǿ����ƽ�ⲻ�ƶ�����CO2�����ʵ����������䣬��D����
��ѡC��
�����㾫����������Ŀ����֪���������û�ѧƽ�ⳣ���ĺ���ͻ�ѧƽ��״̬���ʼ����������֪ʶ���Եõ�����Ĵ𰸣���Ҫ����ָ��һ�������µĿ��淴Ӧ�����Ӧ���淴Ӧ��������ȣ���Ӧ������и���ֵ�Ũ�Ȳ����״̬����ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч����


 ѧ���������ν��Ͼ���ѧ������ϵ�д�
ѧ���������ν��Ͼ���ѧ������ϵ�д� Happy holiday���ּ��������ҵ�㶫���������ϵ�д�
Happy holiday���ּ��������ҵ�㶫���������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ӣ�Ni��Cd���ɳ�������ִ��������й㷺Ӧ�á���֪ij���ӵ�صĵ������ҺΪKOH��Һ����䡢�ŵ簴��ʽ���У�Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2���йظõ�ص�˵����ȷ����
Cd(OH)2 + 2Ni(OH)2���йظõ�ص�˵����ȷ����
A�����ʱ������Ӧ��Ni(OH)2 ��e�� + OH- = NiOOH + H2O
B���������ǻ�ѧ��ת��Ϊ���ܵĹ���
C���ŵ�ʱ����������Һ�ļ��Բ���
D���ŵ�ʱ�������Һ�е�OH-�������ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧһѡ��3:���ʽṹ�����ʡ������ꡢ���Ƚ������仯�����ڿ�ѧ�о���ҵ������Ӧ��ʮ�ֹ㷺���ش���������:
(1)��̬��ԭ�ӵļ۵����Ų�ʽΪ________�������ܡ����Ļ�̬ԭ�Ӻ���δ�ɶԵ��������ٵ���_____________
(2)̪ݼ�ܷ��ӵĽṹ��ʽ��ͼ��ʾ,��������Ϊ������,̪�ܷ�������������ͨ����λ����ϵĵ�ԭ�ӵı����__________ (��1��2��3��4)�����ַǽ���ԭ�ӵĵ縺���ɴ�С��˳��Ϊ____(����Ӧ��Ԫ�ط��ű�ʾ);̼ԭ�ӵ��ӻ��������Ϊ_________
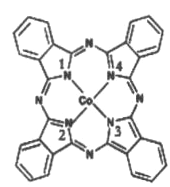
(3)Fe(CO)x�����³�Һ̬,�۵�Ϊ-20.5��,�е�Ϊ103��,�����ڷǼ����ܼ�,�ݴ˿��ж�Fe(CO) x��������_______ (�������),�������Fe(CO) x������ԭ�Ӽ۵������������ṩ������֮��Ϊ18,��x=_________
(4)NiO��FeO�ľ���ṹ�������Ȼ��Ƶ���ͬ,Ni2+��Fe2+�����Ӱ뾶�ֱ�Ϊ69pm��78pm,���۵�NiO ______ FeO(�>����<����=��),ԭ����___________________________��
(5)NiAs�ľ����ṹ��ͼ��ʾ:
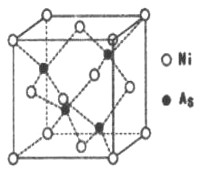
�������ӵ���λ��Ϊ_________��
���������ӵ�������ֵΪNA,�����ܶ�Ϊpg.cm-1,��þ��������������֮��ľ���Ϊ_____cm��(д���������ʽ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С����ʵ����̽�����������(NH2COONH4)�ֽⷴӦƽ�ⳣ���ͷ�Ӧ���ʵIJⶨ����һ���������İ�������粒����������Ƶ��ܱ����������(��������������䣬��������������Բ���)���ں㶨�¶���ʹ��ﵽ�ֽ�ƽ�⣺NH2COONH4(s)![]() 2NH3(g)��CO2(g)
2NH3(g)��CO2(g)
ʵ���ò�ͬ�¶��µ�ƽ�����������±���
�¶�/�� | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
ƽ��������Ũ��/mol��L��1 | 2.4��10��3 | 3.4��10��3 | 4.8��10��3 | 6.8��10��3 | 9.4��10��3 |
��1�������жϸ÷ֽⷴӦ�Ѿ��ﵽƽ�����________��
A��2v(NH3)��v(CO2) B���ܱ���������ѹǿ����
C.�ܱ������л��������ܶȲ��� D���ܱ������а����������������
E����λʱ��������1 molNH2COONH4 ��ͬʱ����2mol NH3
F���ܱ������л�������ƽ��Ħ���������� G��������NH3��CO2��Ũ��֮��Ϊ2��1 H��6��N��H�����ѵ�ͬʱ����2��C=O���γ�
��2�����ݱ������ݣ�����25.0 ��ʱ�ķֽ�ƽ�ⳣ��______________��
��3��ȡһ�����İ�������粒������һ�����������ܱ���������У���25.0 ���´ﵽ�ֽ�ƽ�⡣���ں�����ѹ�������������������粒��������________(������������������������������)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ҹ��ں��պ�����ҵ��ȡ����������Ŀ�ijɾͣ���ѧ����������ת���������������ŷ������˺ܴ��Ŭ��������Ϊ�˴ﵽ���ŷŵ�Ҫ��ѭ���������������CO2���ṩO2�������һ��װ��(��ͼ)ʵ����������ת�����ܷ�Ӧ����ʽΪ2CO2=2CO+O2�����ڸ�װ������˵����ȷ����
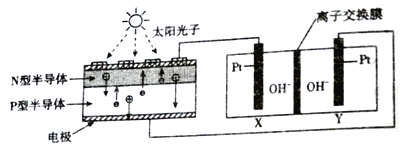
A. װ�������ӽ���ĤΪ�����ӽ���Ĥ
B. CO2����X�缫�ķ�Ӧ����ʽ:CO2+2e-+H2O=CO+2OH-
C. N�Ͱ뵼��Ϊ������P�Ͱ뵼��Ϊ����
D. ���·ÿת��2mol���ӣ�Y����������22.4L(��״��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˲ⶨһ����̬��A�Ļ�ѧʽ��ȡһ������A����һ�ܱ�������ȼ�գ�����ʵ�����������CO2��CO��ˮ������ѧ���ס����������������������Ϊ�����Լ��ķ��������A�����ʽ�����Dz�õ���һ�������µ��й���������(ͼ�еļ�ͷ��ʾ�����ķ���ʵ��ǰϵͳ�ڵĿ������ž�)��
������ȼ�ղ���![]() Ũ��������2.52 g
Ũ��������2.52 g![]() ��ʯ������1.32g
��ʯ������1.32g![]() ����CO21.76 g
����CO21.76 g
�ҷ�����ȼ�ղ���![]() ��ʯ������5.60 g
��ʯ������5.60 g![]() �����С0.64 g
�����С0.64 g![]() ʯ��ˮ����4g���Իش�
ʯ��ˮ����4g���Իش�
(1)�ס����������У�����Ϊ���ַ��������A�����ʽ_______��
(2)�������ѡ��ķ�����ͨ���������A�����ʽ_______��(Ҫ��д���������)
(3)��Ҫȷ��A�ķ���ʽ���Ƿ���Ҫ�ⶨ�������ݣ���˵��ԭ��_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�ֺ�����ﮡ��ܵ����͵��Ӳ��ϣ������в����ķ��������ɹۣ������е����Խ�����������ʽ���ڣ�����Co2O3��CoO����ʽ���ڣ������������ĵ����˫�棺﮻��������С�(��֪Co2O3��������>Cl2��������)�ӷ����л���������(CoO)�Ĺ����������£�
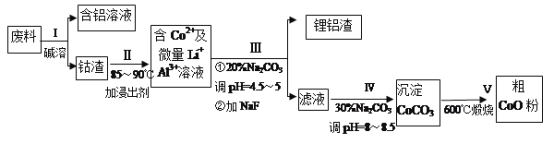
��֪����CoCO3���ܶȻ�Ϊ��Ksp=1.0��10-13��
����Һ������Ũ��С��1.0��10-5mol/Lʱ��Ϊ�����ӳ�����ȫ��
(1)�����ܡ�ǰͨ�������Ϸ��飬��Ŀ����____________��
(2)����I�в���NaOH��Һ�ܳ������е�A1����Ӧ�����ӷ���ʽΪ_________________��
(3)���̢��м���ϡH2SO4�ữ���ټ���Na2S2O3��Һ�����ܡ�������������ʵķ�Ӧ��ѧ����ʽΪ (������ֻ��һ�����) _______________________________________����ʵ����ģ�ҵ����ʱ��Ҳ������������ܣ���ʵ�ʹ�ҵ�����в������ᣬ�����������������ܵ���Ҫԭ��______________________________________��
(4)����III�õ����������Ҫ�ɷ���LiF��AI(OH)3��̼������Һ�ڲ��� Al(OH)3ʱ����Ҫ���ã���д���÷�Ӧ�����ӷ���ʽ__________________________________��
(5)��2.0��10-4 mol/LCoSO4��2.2��10-4mol/L��Na2CO3�������ϣ���ʱ��Һ�е�Co2+��Ũ��Ϊ__________��Co2+�Ƿ������ȫ? __________(��ǡ���)��
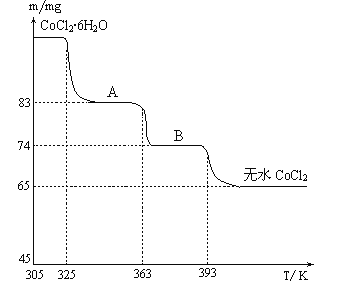
(6)CoO��������ɵ÷ۺ�ɫ��CoCl2��Һ��CoCl2���ᾧˮ��Ŀ��ͬ�����ֲ�ͬ��ɫ��������ɫ����ˮCoCl2��ˮ��ɫ��һ���ʿ��Ƴɱ�ɫˮ�������īˮ����ͼ�Ƿۺ�ɫ��CoCl2��6H2O�������ȷֽ�ʱ��ʣ������������¶ȱ仯�����ߣ�����B�Ļ�ѧʽ��____________________��
���𰸡� �� �� �� �� �� �� �� ��
��������(1). �����ܡ�ǰͨ�������Ϸ��飬����������巴Ӧ��ĽӴ�������ӿ췴Ӧ���ʣ��ʴ�Ϊ������Ӧ��Ӵ�������ӿ췴Ӧ���ʣ�
(2). NaOH��Һ��Al��Ӧ����ƫ�����ƺ����������ӷ���ʽΪ��2A1+2OH��+2H2O=2A1O2��+3H2�����ʴ�Ϊ��2A1+2OH��+2H2O=2A1O2��+3H2����
(3). ����������Co2O3��CoO����ʽ���ڣ��ܵĻ��ϼ�Ϊ+2�ۺ�+3�ۣ�������ͼ��֪������Na2S2O3��Һ����ȫ����Ϊ+2�ۣ�˵��Co3+����S2O32������ԭ����ΪCo2+���ɲ�����ֻ��һ��������ӿ�֪��������ΪSO42�������ݵ�ʧ�����غ��ԭ���غ㣬�����������ʵķ�Ӧ��ѧ����ʽΪ��4Co2O3��CoO+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O����������Ϣ��֪��Co2O3��������>Cl2�������ԣ���Co2O3��CoO�������������Cl2����Ⱦ����������ʵ�ʹ�ҵ�����в�����������������ʣ��ʴ�Ϊ��4Co2O3��CoO+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O��Co2O3��CoO�������������Cl2����Ⱦ������
(4). �ڹ���III�м���̼������Һ��̼������Ӻ������ӷ���˫ˮ�ⷴӦ���������������������ӷ���ʽΪ��2A13++3CO32��+3H2O=2A1(OH)3��+3CO2�����ʴ�Ϊ��2A13++3CO32��+3H2O=2A1(OH)3��+3CO2����
(5). ��2.0��10-4mol/LCoSO4��2.2��10-4mol/L��Na2CO3�������ϣ�Co2����CO32����Ӧ����CoCO3�����ӷ���ʽΪ��Co2��+ CO32��= CoCO3�������ӷ���ʽ��֪����Ӧ�����Һ��c(CO32��)=( 2.2��10-4��2.0��10-4)mol/L��2=1��10��5mol/L����Ӧ�����Һ��c(Co2��)=![]() =1.0��10-8mol/L��c(Co2��)��1.0��10-5mol/L������Co2��������ȫ���ʴ�Ϊ��1.0��10-8mol/L���ǣ�
=1.0��10-8mol/L��c(Co2��)��1.0��10-5mol/L������Co2��������ȫ���ʴ�Ϊ��1.0��10-8mol/L���ǣ�
(6). ��ͼ��֪��n(CoCl2)=65��10-3g��130g/mol=5��10-4mol��B�к���ˮ�����ʵ���Ϊn(H2O)=(74��65)��10-3g��18g/mol=5��10-4mol����n(CoCl2): n(H2O)=1:1��������BΪCoCl2��H2O���ʴ�Ϊ��CoCl2��H2O��
�����͡���span>����
��������
10
����Ŀ����Ԫ�ع㷺��������Ȼ�磬�����仯���ﱻ������ũҩ�����ݼ���ɱ����ȡ�
(1)��ij�����������As2O3��As2O5������As2O5���ȶ��Բ����ͼ1д��As2O3ת��ΪAs2O5���Ȼ�ѧ����ʽ__________________________________��
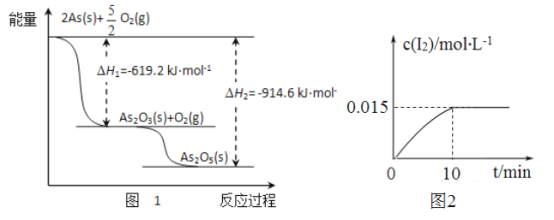
(2)�����ƾ��������ԣ�298Kʱ����100mL�ձ��м���10mL0.1 mol/L Na3AsO4��Һ��20mL0.1 mol/L KI��Һ��20mL0.05mol/L������Һ���������з�Ӧ��AsO43-(��ɫ)+12(dz��ɫ)+H2O ��H�������Һ��c(I2)��ʱ��(t)�Ĺ�ϵ��ͼ2��ʾ(��Һ����仯���Բ���)��
�������¶ȣ���Һ��AsO43-��ƽ��ת���ʼ�С����÷�Ӧ�ġ�H________0(����ڡ���С�ڡ����ڡ�)��
��0~10min�ڣ�I�ķ�Ӧ����v(I��)= ____________��
��������������������淴Ӧ�ﵽƽ��״̬����_______(����ĸ����)��
a.c(AsO33-)+c(AsO42-)���ٱ仯 b.��Һ��ɫ���ֲ��ٱ仯
C.c(AsO33-)��c(AsO42-)�ı�ֵ���ֲ��ٱ仯 d.I���������ʵ���I2����������
���ڸ������£�������Ӧƽ�ⳣ���ı���ʽK=______________��
(3)����(2)�з�Ӧ�ɲⶨ��As2O3��As2O5�������еĸ���ֺ���(�������ʶԲⶨ��Ӱ��)���������£�
�ٽ�����02000g����NaOH��Һ���õ���AO33-��AsO43-�Ļ����Һ��
���������Һ��0.02500 mol��L-1��I2��Һ�ζ����õ�����Һ��ָʾ������________________����ζ��ﵽ�յ㡣�ظ��ζ�3�Σ�ƽ������I2��Һ40.00mL����������As2O5������������_________(������λ��Ч����)�����ζ��յ�ʱ�����Ӷ�������������_________ (�ƫ�͡�����ƫ�ߡ�������Ӱ�족)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������˻ᡰ���ơ����ȼ���DZ��飨C3H8��������������˻���ȼ���DZ�ϩ��C3H6����
��1����������ɵñ�ϩ�� ��֪��C3H8��g��=CH4��g��+HC��CH��g��+H2��g������H1=+156.6kJmol��1
CH3CH=CH2��g��=CH4��g��+HC��CH��g������H2=+32.4kJmol��1
����ͬ�����£���ӦC3H8��g��=CH3CH=CH2��g��+H2��g���ġ�H=kJmol��1
��2���Ա���Ϊȼ����������ȼ�ϵ�أ���ص�����ͨ��O2��CO2 �� ����ͨ����飬�����������̼���Σ�����ܷ�Ӧ����ʽ���ŵ�ʱ��CO32�������ص� �����������������
��3��̼�⻯������ȫȼ������CO2��H2O�����³�ѹ�£������е�CO2����ˮ���ﵽƽ��ʱ����Һ��pH=5.60��c��H2CO3��=1.5��10��5 mol/L��������ˮ�ĵ��뼰H2CO3�ĵڶ������룬��H2CO3HCO3��+H+��ƽ�ⳣ��K1= �� ����֪��10��5.60=2.5��10��6��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ�����ǽ�����ҵ���õ�ճ�ϼ�����������ľ�ķ���ͷ���������ˮ����Ϊ
A. CaSiO3���� B. SiO2
C. Na2SiO3ˮ��Һ D. H2SiO3
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com