
【题目】北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6).
(1)丙烷脱氢可得丙烯. 已知:C3H8(g)=CH4(g)+HC≡CH(g)+H2(g);△H1=+156.6kJmol﹣1
CH3CH=CH2(g)=CH4(g)+HC≡CH(g);△H2=+32.4kJmol﹣1
则相同条件下,反应C3H8(g)=CH3CH=CH2(g)+H2(g)的△H=kJmol﹣1
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2 , 负极通入丙烷,电解质是熔融碳酸盐.电池总反应方程式;放电时,CO32﹣移向电池的 (填“正”或“负”)极.
(3)碳氢化合物完全燃烧生成CO2和H2O.常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10﹣5 mol/L.若忽略水的电离及H2CO3的第二级电离,则H2CO3HCO3﹣+H+的平衡常数K1= . (已知:10﹣5.60=2.5×10﹣6)
【答案】
(1)124.2
(2)C3H8+5O2═3CO2+4H2O;负
(3)4.2×10﹣7 mol?L﹣1
【解析】解:(1)已知:①C3H8(g)═CH4(g)+HC≡CH(g)+H2(g)△H1=156.6kJmol﹣1
②CH3CH=CH2(g)═CH4(g)+HC≡CH(g )△H2=32.4kJmol﹣1
根据盖斯定律,①﹣②得C3H8(g)═CH3CH=CH2(g)+H2(g),所以△H=△H1﹣△H2=156.6kJmol﹣1﹣32.4kJmol﹣1=124.2kJmol﹣1;
所以答案是:124.2;(2)负极通入丙烷,碳元素的化合价升高,电池的正极通入O2,氧元素的化合价降低,即丙烷与氧气反应生成二氧化碳和水,则电池的总反应为C3H8+5O2═3CO2+4H2O,原电池中阴离子向负极移动,即CO32﹣移向电池的负极,所以答案是:C3H8+5O2═3CO2+4H2O;负;(3)忽略水的电离及H2CO3的第二级电离,pH=5.60,c(H+)=10﹣5.60=2.5×10﹣6molL﹣1,
由H2CO3HCO3﹣+H+,
平衡时c(H+)=c(HCO3﹣)=2.5×10﹣6molL﹣1,
c(H2CO3)=(1.5×10﹣5﹣2.5×10﹣6)molL﹣1,
则Ka= ![]() =4.2×10﹣7 molL﹣1,
=4.2×10﹣7 molL﹣1,
所以答案是:4.2×10﹣7 molL﹣1.
【考点精析】掌握反应热和焓变是解答本题的根本,需要知道在化学反应中放出或吸收的热量,通常叫反应热.


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。请回答下列问题:
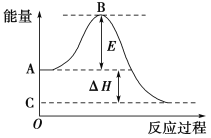
(1)图中A点表示:___________, B点表示:__________,E的大小对该反应的反应热________(填“有”或“无”)影响。
(2)图中ΔH=________kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有可逆反应Fe(s)+CO2(g)FeO(s)+CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2,下列叙述正确的是( )
A.该反应达到平衡状态时c(CO2)=c(CO)
B.该反应的正反应是放热反应
C.若起始时把Fe和2.0mol CO2放入体积固定为1 L的密闭容器中,某温度时达到平衡,此时容器中CO的浓度为1.0 mol/L,则该温度下上述反应的平衡常数K=1.0
D.若该反应在体积固定的密闭容器中进行,在恒温下达到平衡状态,再通入CO反应混合气体中CO2的物质的量分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面图(1)和图(2)是A、B两种物质的核磁共振氢谱。已知A、B两种物质都是烃类,都含有6个氢原子。请根据图(1)和图(2)两种物质的核磁共振氢谱图选择出可能属于图(1)和图(2)的两种物质 ( )
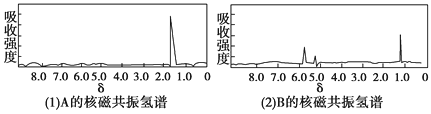
A. A是C3H6;B是C3H6 B. A是C6H6;B是C4H10
C. A是C3H8;B是C6H6 D. A是C3H6;B是C2H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。部分元素在周期表中位置如下:

回答下列问题:
(1)六种元素中,非金属性最强的元素是:_______。写出 As 原子的最外层的电子排布式_______,As 原子核外有_______个未成对电子。
(2)根据元素周期律,可判断原子半径Ga_______As。(选填“>”、“<”或“=”)。写出铝的最高价氧化物对应水化物的电离方程式:______。
(3)NH3 的 分 子 构 型 是_____。 GaF3 的 熔 点 高 于 1000℃ , GaCl3 的 熔 点 为 77.9℃ , 可 能 的 原 因 是_____。写出 C2H2 的电子式为:____。
(4)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
A. 在不同生物的细胞内,组成它们的化学元素的种类基本相同
B. 细胞中各种化合物的共有元素是C、H、O
C. 镁是植物必需的微量元素,因为合成叶绿素时需要镁作原料
D. 组成生物体的大量元素中,C是最基本的元素,在细胞鲜重中含量总是最多的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸性工业废水中含有K2Cr2O7 . 光照下,草酸(H2C2O4)能将其中的Cr2O72﹣转化为Cr3+ . 某课题组研究发现,少量铁明矾[Al2Fe(SO4)424H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表
实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
① | 4 | 60 | 10 | 30 |
② | 5 | 60 | 10 | 30 |
③ | 5 | 60 |
测得实验①和②溶液中的Cr2O72﹣浓度随时间变化关系如图所示.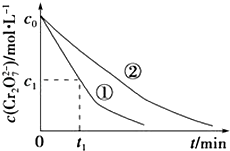
(2)上述反应后草酸被氧化的离子方程式为
(3)实验①和②的结果表明;实验①中0~t1时间段反应速率v(Cr3+)=molL﹣1min﹣1(用代数式表示).
(4)该课题组对铁明矾[Al2Fe(SO4)424H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三: 假设一:Fe2+起催化作用:
假设二:;
假设三:;
(5)请你设计实验验证上述假设一,完成下表中内容. (除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4Al2(SO4)324H2O、Al2(SO4)3等.溶液中Cr2O72﹣的浓度可用仪器测定)
实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是新型的汽车动力燃料。工业上可通过H2和CO化合制备甲醇,该反应的热化学方程式为:2H2(g)+CO(g) ![]() CH3OH(g) △H=-116kJ/mol
CH3OH(g) △H=-116kJ/mol
(1)已知:CO和H2的燃烧热分别为283kJ/mol、286kJ/mol 。1mol甲醇气体完全燃烧生成CO2和液态水的热化学方程式为_________________________________。
(2)下列措施中有利于提高2H2(g)+CO(g)![]() CH3OH(g)反应速率及原料平衡转化率的是_____(填标号)。
CH3OH(g)反应速率及原料平衡转化率的是_____(填标号)。
A.分离出CH3OH B.升高温度 C.增大压强 D.加入合适的催化剂
(3)在容积为2L的恒容容器中,分别在230℃、250℃、270℃下,改变H2和CO的起始组成比[(n(H2)/n(CO)],起始时CO的物质的量固定为1mol,实验结果如图所示:
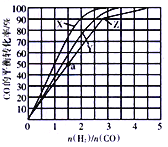
①Z曲线对应的温度是__________,判断的依据是________________。
②从图中可以得出的结论是(写两条)____________________、______________________。
(4)利用图中a点对应的数据,计算曲线Z对应温度下反应2H2(g)+CO(g)![]() CH3OH(g)的平衡常数为____________;若在a点向容器中再充入1.5molCH3OH和0.5molH2,则原平衡___移动(填“向正反应方向”或“向逆反应方向”或“不”)
CH3OH(g)的平衡常数为____________;若在a点向容器中再充入1.5molCH3OH和0.5molH2,则原平衡___移动(填“向正反应方向”或“向逆反应方向”或“不”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以甲烷为原料合成甲醇的反应如下:
反应I:CH4(g) + CO2(g) ![]() 2CO(g) + 2H2(g) △H1= +247 kJ/mol
2CO(g) + 2H2(g) △H1= +247 kJ/mol
反应II:CO(g) + 2H2(g)![]() CH3OH(g) △H2=-90kJ/mol
CH3OH(g) △H2=-90kJ/mol
已知: T1℃时,反应II 的平衡常数数值为100;T2℃时,反应II 在密闭容器中达到平衡,测得CO、H2、CH3OH的物质的量浓度(mol/L)分别为0.05、0.1、0.1。下列说法中,正确的是
A. 反应I中,使用催化剂可以减小△H1,提高反应速率
B. 反应II 中,加热或加压均可提高原料气的平衡转化率
C. 由上述数据可判断反应II 的温度: T1> T2
D. CO(g)+CH3OH(g)![]() CH4(g) +CO2(g) △H= +157 kJ/mol
CH4(g) +CO2(g) △H= +157 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com