
【题目】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。部分元素在周期表中位置如下:

回答下列问题:
(1)六种元素中,非金属性最强的元素是:_______。写出 As 原子的最外层的电子排布式_______,As 原子核外有_______个未成对电子。
(2)根据元素周期律,可判断原子半径Ga_______As。(选填“>”、“<”或“=”)。写出铝的最高价氧化物对应水化物的电离方程式:______。
(3)NH3 的 分 子 构 型 是_____。 GaF3 的 熔 点 高 于 1000℃ , GaCl3 的 熔 点 为 77.9℃ , 可 能 的 原 因 是_____。写出 C2H2 的电子式为:____。
(4)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因_____。

【答案】 P 4s24p3 3 > Al(OH)3![]() Al3++3OH_或Al(OH)3
Al3++3OH_或Al(OH)3![]() H++AlO2-+H2O 三角锥形 GaF3是离子晶体,GaCl3 是分子晶体
H++AlO2-+H2O 三角锥形 GaF3是离子晶体,GaCl3 是分子晶体 ![]() GeCl4、GeBr4、GeI4 的熔沸点依次上升。因为其组成和结构相似的物质,都是分子晶体,随分子增大, 范德华力增大,熔沸点上升
GeCl4、GeBr4、GeI4 的熔沸点依次上升。因为其组成和结构相似的物质,都是分子晶体,随分子增大, 范德华力增大,熔沸点上升
【解析】(1)元素周期表中从左到右非金属性逐渐增强,从上而下非金属性逐渐减弱,故六种元素中,非金属性最强的元素是P;As的原子序数是33,则基态As原子的核外电子排布式为1s22s22p63s23p63d104s24p3,最外层的电子排布式为4s24p3;As 原子核外有3个未成对电子;(2)同周期自左向右原子半径逐渐减下,则原子半径Ga>As;铝的最高价氧化物对应水化物Al(OH)3是两性氢氧化物,具有弱碱性,其电离方程式为:Al(OH)3![]() Al3++3OH_或Al(OH)3
Al3++3OH_或Al(OH)3![]() H++AlO2-+H2O;(3)NH3分子的价层电子对数=3+
H++AlO2-+H2O;(3)NH3分子的价层电子对数=3+![]() =4,即含有一对孤对电子,所以立体构型为三角锥形;由于GaF3是离子晶体,GaCl3是分子晶体,所以离子晶体GaF3的熔沸点高;C2H2 的电子式为:
=4,即含有一对孤对电子,所以立体构型为三角锥形;由于GaF3是离子晶体,GaCl3是分子晶体,所以离子晶体GaF3的熔沸点高;C2H2 的电子式为:![]() ;(4)GeCl4 、GeBr4 、GeI4 的熔沸点依次上升。因为其组成和结构相似的物质,都是分子晶体,随分子增大, 范德华力增大,熔沸点上升。
;(4)GeCl4 、GeBr4 、GeI4 的熔沸点依次上升。因为其组成和结构相似的物质,都是分子晶体,随分子增大, 范德华力增大,熔沸点上升。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有关细胞物质组成的叙述,正确的是
A. 在人体活细胞中氧原子的数目最多
B. 脂肪细胞含量最多的化合物是脂肪
C. 每种细胞所含的有机物最多的都是蛋白质
D. 组成蛋白质的元素一定有C、H、O、N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,我国在航空航天事业上取得了令人瞩目的成就,科学家在能量的转化,航天器的零排放作出了很大的努力,其中为了达到零排放的要求,循环利用人体呼出的CO2并提供O2,设计了一种装置(如图)实现了能量的转化。总反应方程式为2CO2=2CO+O2。关于该装置下列说法正确的是
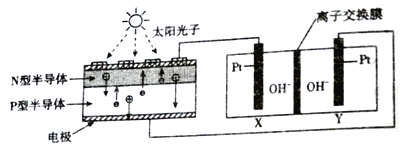
A. 装置中离子交换膜为阳离子交换膜
B. CO2参与X电极的反应方程式:CO2+2e-+H2O=CO+2OH-
C. N型半导体为正极,P型半导体为负极
D. 外电路每转移2mol电子,Y极生成气体22.4L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面:锂混杂于其中。(已知Co2O3的氧化性>Cl2的氧化性)从废料中回收氧化钴(CoO)的工艺流程如下:
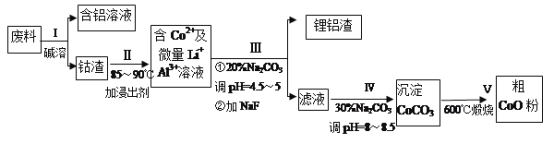
已知:①CoCO3的溶度积为:Ksp=1.0×10-13;
②溶液中离子浓度小于1.0×10-5mol/L时认为该离子沉淀完全。
(1)“碱溶”前通常将废料粉碎,其目的是____________。
(2)过程I中采用NaOH溶液溶出废料中的A1,反应的离子方程式为_________________。
(3)过程Ⅱ中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出含钻物质的反应化学方程式为 (产物中只有一种酸根) _______________________________________。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请分析不用盐酸浸出钴的主要原因______________________________________。
(4)过程III得到锂铝渣的主要成分是LiF和AI(OH)3,碳酸钠溶液在产生 Al(OH)3时起重要作用,请写出该反应的离子方程式__________________________________。
(5)将2.0×10-4 mol/LCoSO4与2.2×10-4mol/L的Na2CO3等体积混合,此时溶液中的Co2+的浓度为__________,Co2+是否沉淀完全? __________(填“是”或“否”)。
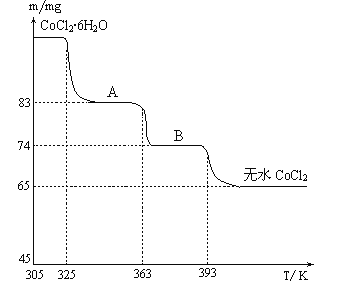
(6)CoO溶于盐酸可得粉红色的CoCl2溶液。CoCl2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水。如图是粉红色的CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,物质B的化学式是____________________。
【答案】 略 略 略 略 略 略 略 略
【解析】(1). “碱溶”前通常将废料粉碎,可以增大固体反应物的接触面积,加快反应速率,故答案为:增大反应物接触面积,加快反应速率;
(2). NaOH溶液和Al反应生成偏铝酸钠和氢气,离子方程式为:2A1+2OH-+2H2O=2A1O2-+3H2↑,故答案为:2A1+2OH-+2H2O=2A1O2-+3H2↑;
(3). 废料中钴以Co2O3·CoO的形式存在,钴的化合价为+2价和+3价,由流程图可知,加入Na2S2O3溶液后,钴全部变为+2价,说明Co3+氧化S2O32-,还原产物为Co2+,由产物中只有一种酸根离子可知氧化产物为SO42-,根据得失电子守恒和原子守恒,浸出含钴物质的反应化学方程式为:4Co2O3·CoO+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O,由题中信息可知,Co2O3的氧化性>Cl2的氧化性,则Co2O3·CoO可氧化盐酸产生Cl2,污染环境,所以实际工业生产中不用盐酸浸出含钴物质,故答案为:4Co2O3·CoO+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O;Co2O3·CoO可氧化盐酸产生Cl2,污染环境;
(4). 在过程III中加入碳酸钠溶液,碳酸根离子和铝离子发生双水解反应生成氢氧化铝沉淀,离子方程式为:2A13++3CO32-+3H2O=2A1(OH)3↓+3CO2↑,故答案为:2A13++3CO32-+3H2O=2A1(OH)3↓+3CO2↑;
(5). 将2.0×10-4mol/LCoSO4与2.2×10-4mol/L的Na2CO3等体积混合,Co2+与CO32-反应生成CoCO3,离子方程式为:Co2++ CO32-= CoCO3,由离子方程式可知,反应后的溶液中c(CO32-)=( 2.2×10-4-2.0×10-4)mol/L÷2=1×10-5mol/L,则反应后的溶液中c(Co2+)=![]() =1.0×10-8mol/L,c(Co2+)<1.0×10-5mol/L,所以Co2+沉淀完全,故答案为:1.0×10-8mol/L;是;
=1.0×10-8mol/L,c(Co2+)<1.0×10-5mol/L,所以Co2+沉淀完全,故答案为:1.0×10-8mol/L;是;
(6). 据图可知,n(CoCl2)=65×10-3g÷130g/mol=5×10-4mol,B中含有水的物质的量为n(H2O)=(74-65)×10-3g÷18g/mol=5×10-4mol,则n(CoCl2): n(H2O)=1:1,则物质B为CoCl2·H2O,故答案为:CoCl2·H2O。
【题型】综span>合题
【结束】
10
【题目】砷元素广泛存在于自然界,砷与其化合物被运用在农药、除草剂、杀虫剂等。
(1)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据图1写出As2O3转化为As2O5的热化学方程式__________________________________。
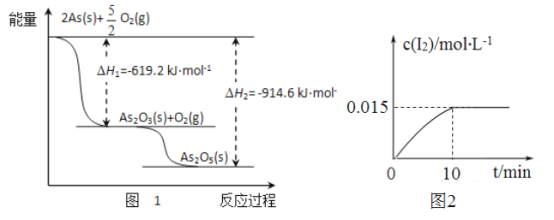
(2)砷酸钠具有氧化性,298K时,在100mL烧杯中加入10mL0.1 mol/L Na3AsO4溶液、20mL0.1 mol/L KI溶液和20mL0.05mol/L硫酸溶液,发生下列反应:AsO43-(无色)+12(浅黄色)+H2O △H。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
①升高温度,溶液中AsO43-的平衡转化率减小,则该反应的△H________0(填“大于”“小于”或“等于”)。
②0~10min内,I的反应速率v(Iˉ)= ____________。
③下列情况表明上述可逆反应达到平衡状态的是_______(填字母代号)。
a.c(AsO33-)+c(AsO42-)不再变化 b.溶液颜色保持不再变化
C.c(AsO33-)与c(AsO42-)的比值保持不再变化 d.I的生成速率等于I2的生成速率
④在该条件下,上述反应平衡常数的表达式K=______________。
(3)利用(2)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
①将试样02000g溶于NaOH溶液,得到含AO33-和AsO43-的混合溶液。
②上述混合液用0.02500 mol·L-1的I2溶液滴定,用淀粉试液做指示剂,当________________,则滴定达到终点。重复滴定3次,平均消耗I2溶液40.00mL。则试样中As2O5的质量分数是_________(保留四位有效数字)。若滴定终点时,仰视读数,则所测结果_________ (填“偏低”,“偏高”,“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系正确的是( )
A. 熔点:戊烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷
B. 密度:CCl4>CHCl3>H2O>己烷
C. 同质量的物质燃烧耗O2量:丙炔>乙烷>乙烯>乙炔>甲烷
D. 同物质的量物质燃烧耗O2量:己烷>环己烷>苯>苯甲酸(C7H6O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6).
(1)丙烷脱氢可得丙烯. 已知:C3H8(g)=CH4(g)+HC≡CH(g)+H2(g);△H1=+156.6kJmol﹣1
CH3CH=CH2(g)=CH4(g)+HC≡CH(g);△H2=+32.4kJmol﹣1
则相同条件下,反应C3H8(g)=CH3CH=CH2(g)+H2(g)的△H=kJmol﹣1
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2 , 负极通入丙烷,电解质是熔融碳酸盐.电池总反应方程式;放电时,CO32﹣移向电池的 (填“正”或“负”)极.
(3)碳氢化合物完全燃烧生成CO2和H2O.常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10﹣5 mol/L.若忽略水的电离及H2CO3的第二级电离,则H2CO3HCO3﹣+H+的平衡常数K1= . (已知:10﹣5.60=2.5×10﹣6)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在细胞内水的主要功能是( )
①生命活动的良好溶剂
②运输营养物质和代谢废物
③决定细胞形态
④维持生物大分子的空间结构
A. ①②③ B. ②③④ C. ①②④ D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化合物的说法正确的是
A. 干冰的主要成分是H2O B. 吸入CO可导致人体中毒
C. SO2可大量用于漂白食品 D. 小苏打的主要成份是Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分离提纯是化工生产中常用的方法。下列说法合理的是
A. 蒸馏自来水可得到蒸馏水
B. 酸溶法除去Al2O3的Fe2O3
C. 过滤法除去乙酸中的乙醇
D. 碱溶法除去Al2O3中的SiO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com