
����Ŀ��ij���Թ�ҵ��ˮ�к���K2Cr2O7 �� �����£����ᣨH2C2O4���ܽ����е�Cr2O72��ת��ΪCr3+ �� ij�������о����֣�����������[Al2Fe��SO4��424H2O]���ɶԸ÷�Ӧ������ã�Ϊ��һ���о��й����ضԸ÷�Ӧ���ʵ�Ӱ�죬̽�����£�
��1����25���£����ƹ���ǿ�ȡ���ˮ��Ʒ��ʼŨ�Ⱥʹ���������ͬ�����ڲ�ͬ�ij�ʼpH��һ��Ũ�Ȳ�����Һ���������Ա�ʵ�飬�������ʵ����Ʊ�
ʵ���� | ��ʼpH | ��ˮ��Ʒ���/mL | ������Һ���/mL | ����ˮ���/mL |
�� | 4 | 60 | 10 | 30 |
�� | 5 | 60 | 10 | 30 |
�� | 5 | 60 |
���ʵ��ٺ͢���Һ�е�Cr2O72��Ũ����ʱ��仯��ϵ��ͼ��ʾ��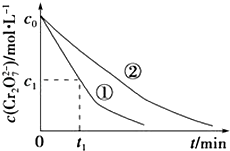
��2��������Ӧ����ᱻ���������ӷ���ʽΪ
��3��ʵ��ٺ͢ڵĽ��������ʵ�����0��t1ʱ��η�Ӧ����v��Cr3+��=molL��1min��1���ô���ʽ��ʾ����
��4���ÿ������������[Al2Fe��SO4��424H2O]��������õijɷ�������¼��裬������ɼ�����ͼ������� ����һ��Fe2+������ã�
���������
����������
��5���������ʵ����֤��������һ������±������ݣ� ����������ʵ���ṩ���Լ��⣬�ɹ�ѡ���ҩƷ��K2SO4��FeSO4��K2SO4Al2��SO4��324H2O��Al2��SO4��3�ȣ���Һ��Cr2O72����Ũ�ȿ��������ⶨ��
ʵ�鷽������Ҫ��д����������̣� | Ԥ��ʵ�����ͽ��� |
���𰸡�
��1��20��20
��2��Cr2O72��+3H2C2O4+8H+=6CO2��+2Cr3++7H2O
��3����ҺPH�Ը÷�Ӧ��������Ӱ�죻 ![]()
��4��Al3+������ã� SO42���������
��5���õ����ʵ���K2SO4?Al2��SO4��3?24H2O����ʵ����е�������,����������Ӧ������ʵ�����ͬ,���жԱ�ʵ�飻��Ӧ������ͬʱ���,����Һ��c��Cr2O72��������ʵ�����c��Cr2O72����,�����һ������������Һ�е�c��Cr2O72������ͬ,�����һ������
���������⣺��1���٢���PH��ͬ����̽��PH�����ʵ�Ӱ�죻��ڢ���̽����ͬŨ��ʱ��������ʵ�Ӱ�죬���Դ��ǣ�
ʵ���� | ��ʼ pH | ��ˮ��Ʒ ���/mL | ������Һ ���/mL | ����ˮ ���/mL |
�� | 20 | 20 |
����2��������̼Ԫ�ػ��ϼ�Ϊ+3�ۣ���������ΪCO2��������Ϊ+4�ۣ����ϼ۹�����2�ۣ�Cr2O72��ת��ΪCr3+�����ϼ۹�������6�ۣ����ݵ����غ㣬�μӷ�Ӧ��Cr2O72�����������ʵ���֮��Ϊ��1��3�����ӷ���ʽΪ��Cr2O72��+3H2C2O4+8H+=6CO2��+2Cr3++7H2O��
���Դ��ǣ�Cr2O72��+3H2C2O4+8H+=6CO2��+2Cr3++7H2O����3����ʵ��٢ڱ�����ҺpHԽС����Ӧ������Խ�죬������ҺpH�Ը÷�Ӧ��������Ӱ�죬v��Cr3+��=2v��Cr2O72����= ![]() molL��1min��1��
molL��1min��1��
���Դ��ǣ���ҺpH�Ը÷�Ӧ��������Ӱ�죻 ![]() ����4������������[Al2Fe��SO4��424H2O]��ɷ�����Al3+������ã�SO42��������ã�
����4������������[Al2Fe��SO4��424H2O]��ɷ�����Al3+������ã�SO42��������ã�
���Դ��ǣ�Al3+������ã�SO42��������ã���5��Ҫ֤��Fe2+������ã������Ա�ʵ�飬����û��Fe2+����ʱ��ʵ�飬����ҪѡK2SO4Al2��SO4��324H2O��ע��������Ҫ����Al3+��SO42��Ũ�ȱȣ���Ҫѡ��K2SO4��Al2��SO4��3���õ����ʵ���K2SO4Al2��SO4��324H2O����ʵ����е�������������������Ӧ������ʵ�����ͬ�����жԱ�ʵ�飬��Ӧ������ͬʱ�������Һ��c��Cr2O72��������ʵ�����c��Cr2O72�����������һ������������Һ�е�c��Cr2O72������ͬ�������һ�����������Դ��ǣ�
ʵ�鷽�� | Ԥ��ʵ�����ͽ��� |
�õ����ʵ���K2SO4Al2��SO4��324H2O����ʵ����е�������������������Ӧ������ʵ�����ͬ�����жԱ�ʵ�� | ��Ӧ������ͬʱ�������Һ��c��Cr2O72��������ʵ�����c��Cr2O72�����������һ������������Һ�е�c��Cr2O72������ͬ�������һ������ |


 ��ѧʵ����ϵ�д�
��ѧʵ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧһѡ��3:���ʽṹ�����ʡ������ꡢ���Ƚ������仯�����ڿ�ѧ�о���ҵ������Ӧ��ʮ�ֹ㷺���ش���������:
(1)��̬��ԭ�ӵļ۵����Ų�ʽΪ________�������ܡ����Ļ�̬ԭ�Ӻ���δ�ɶԵ��������ٵ���_____________
(2)̪ݼ�ܷ��ӵĽṹ��ʽ��ͼ��ʾ,��������Ϊ������,̪�ܷ�������������ͨ����λ����ϵĵ�ԭ�ӵı����__________ (��1��2��3��4)�����ַǽ���ԭ�ӵĵ縺���ɴ�С��˳��Ϊ____(����Ӧ��Ԫ�ط��ű�ʾ);̼ԭ�ӵ��ӻ��������Ϊ_________
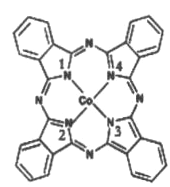
(3)Fe(CO)x�����³�Һ̬,�۵�Ϊ-20.5��,�е�Ϊ103��,�����ڷǼ����ܼ�,�ݴ˿��ж�Fe(CO) x��������_______ (�������),�������Fe(CO) x������ԭ�Ӽ۵������������ṩ������֮��Ϊ18,��x=_________
(4)NiO��FeO�ľ���ṹ�������Ȼ��Ƶ���ͬ,Ni2+��Fe2+�����Ӱ뾶�ֱ�Ϊ69pm��78pm,���۵�NiO ______ FeO(�>����<����=��),ԭ����___________________________��
(5)NiAs�ľ����ṹ��ͼ��ʾ:
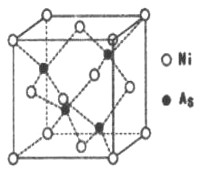
�������ӵ���λ��Ϊ_________��
���������ӵ�������ֵΪNA,�����ܶ�Ϊpg.cm-1,��þ��������������֮��ľ���Ϊ_____cm��(д���������ʽ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
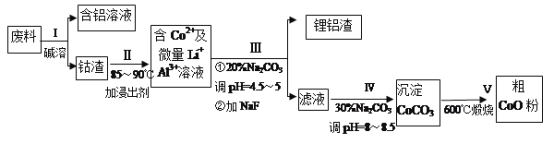
����Ŀ��һ�ֺ�����ﮡ��ܵ����͵��Ӳ��ϣ������в����ķ��������ɹۣ������е����Խ�����������ʽ���ڣ�����Co2O3��CoO����ʽ���ڣ������������ĵ����˫�棺﮻��������С�(��֪Co2O3��������>Cl2��������)�ӷ����л���������(CoO)�Ĺ����������£�
��֪����CoCO3���ܶȻ�Ϊ��Ksp=1.0��10-13��
����Һ������Ũ��С��1.0��10-5mol/Lʱ��Ϊ�����ӳ�����ȫ��
(1)�����ܡ�ǰͨ�������Ϸ��飬��Ŀ����____________��
(2)����I�в���NaOH��Һ�ܳ������е�A1����Ӧ�����ӷ���ʽΪ_________________��
(3)���̢��м���ϡH2SO4�ữ���ټ���Na2S2O3��Һ�����ܡ�������������ʵķ�Ӧ��ѧ����ʽΪ (������ֻ��һ�����) _______________________________________����ʵ����ģ�ҵ����ʱ��Ҳ������������ܣ���ʵ�ʹ�ҵ�����в������ᣬ�����������������ܵ���Ҫԭ��______________________________________��
(4)����III�õ����������Ҫ�ɷ���LiF��AI(OH)3��̼������Һ�ڲ��� Al(OH)3ʱ����Ҫ���ã���д���÷�Ӧ�����ӷ���ʽ__________________________________��
(5)��2.0��10-4 mol/LCoSO4��2.2��10-4mol/L��Na2CO3�������ϣ���ʱ��Һ�е�Co2+��Ũ��Ϊ__________��Co2+�Ƿ������ȫ? __________(��ǡ���)��
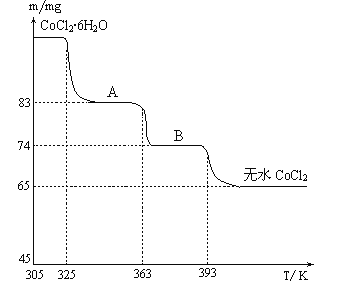
(6)CoO��������ɵ÷ۺ�ɫ��CoCl2��Һ��CoCl2���ᾧˮ��Ŀ��ͬ�����ֲ�ͬ��ɫ��������ɫ����ˮCoCl2��ˮ��ɫ��һ���ʿ��Ƴɱ�ɫˮ�������īˮ����ͼ�Ƿۺ�ɫ��CoCl2��6H2O�������ȷֽ�ʱ��ʣ������������¶ȱ仯�����ߣ�����B�Ļ�ѧʽ��____________________��
���𰸡� �� �� �� �� �� �� �� ��
��������(1). �����ܡ�ǰͨ�������Ϸ��飬����������巴Ӧ��ĽӴ�������ӿ췴Ӧ���ʣ��ʴ�Ϊ������Ӧ��Ӵ�������ӿ췴Ӧ���ʣ�
(2). NaOH��Һ��Al��Ӧ����ƫ�����ƺ����������ӷ���ʽΪ��2A1+2OH��+2H2O=2A1O2��+3H2�����ʴ�Ϊ��2A1+2OH��+2H2O=2A1O2��+3H2����
(3). ����������Co2O3��CoO����ʽ���ڣ��ܵĻ��ϼ�Ϊ+2�ۺ�+3�ۣ�������ͼ��֪������Na2S2O3��Һ����ȫ����Ϊ+2�ۣ�˵��Co3+����S2O32������ԭ����ΪCo2+���ɲ�����ֻ��һ��������ӿ�֪��������ΪSO42�������ݵ�ʧ�����غ��ԭ���غ㣬�����������ʵķ�Ӧ��ѧ����ʽΪ��4Co2O3��CoO+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O����������Ϣ��֪��Co2O3��������>Cl2�������ԣ���Co2O3��CoO�������������Cl2����Ⱦ����������ʵ�ʹ�ҵ�����в�����������������ʣ��ʴ�Ϊ��4Co2O3��CoO+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O��Co2O3��CoO�������������Cl2����Ⱦ������
(4). �ڹ���III�м���̼������Һ��̼������Ӻ������ӷ���˫ˮ�ⷴӦ���������������������ӷ���ʽΪ��2A13++3CO32��+3H2O=2A1(OH)3��+3CO2�����ʴ�Ϊ��2A13++3CO32��+3H2O=2A1(OH)3��+3CO2����
(5). ��2.0��10-4mol/LCoSO4��2.2��10-4mol/L��Na2CO3�������ϣ�Co2����CO32����Ӧ����CoCO3�����ӷ���ʽΪ��Co2��+ CO32��= CoCO3�������ӷ���ʽ��֪����Ӧ�����Һ��c(CO32��)=( 2.2��10-4��2.0��10-4)mol/L��2=1��10��5mol/L����Ӧ�����Һ��c(Co2��)=![]() =1.0��10-8mol/L��c(Co2��)��1.0��10-5mol/L������Co2��������ȫ���ʴ�Ϊ��1.0��10-8mol/L���ǣ�
=1.0��10-8mol/L��c(Co2��)��1.0��10-5mol/L������Co2��������ȫ���ʴ�Ϊ��1.0��10-8mol/L���ǣ�
(6). ��ͼ��֪��n(CoCl2)=65��10-3g��130g/mol=5��10-4mol��B�к���ˮ�����ʵ���Ϊn(H2O)=(74��65)��10-3g��18g/mol=5��10-4mol����n(CoCl2): n(H2O)=1:1��������BΪCoCl2��H2O���ʴ�Ϊ��CoCl2��H2O��
�����͡���span>����
��������
10
����Ŀ����Ԫ�ع㷺��������Ȼ�磬�����仯���ﱻ������ũҩ�����ݼ���ɱ����ȡ�
(1)��ij�����������As2O3��As2O5������As2O5���ȶ��Բ����ͼ1д��As2O3ת��ΪAs2O5���Ȼ�ѧ����ʽ__________________________________��
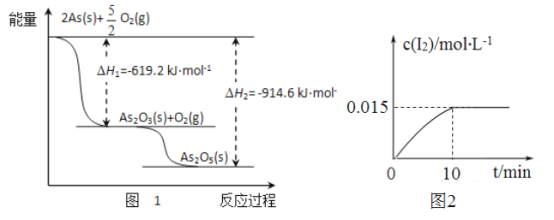
(2)�����ƾ��������ԣ�298Kʱ����100mL�ձ��м���10mL0.1 mol/L Na3AsO4��Һ��20mL0.1 mol/L KI��Һ��20mL0.05mol/L������Һ���������з�Ӧ��AsO43-(��ɫ)+12(dz��ɫ)+H2O ��H�������Һ��c(I2)��ʱ��(t)�Ĺ�ϵ��ͼ2��ʾ(��Һ����仯���Բ���)��
�������¶ȣ���Һ��AsO43-��ƽ��ת���ʼ�С����÷�Ӧ�ġ�H________0(����ڡ���С�ڡ����ڡ�)��
��0~10min�ڣ�I�ķ�Ӧ����v(I��)= ____________��
��������������������淴Ӧ�ﵽƽ��״̬����_______(����ĸ����)��
a.c(AsO33-)+c(AsO42-)���ٱ仯 b.��Һ��ɫ���ֲ��ٱ仯
C.c(AsO33-)��c(AsO42-)�ı�ֵ���ֲ��ٱ仯 d.I���������ʵ���I2����������
���ڸ������£�������Ӧƽ�ⳣ���ı���ʽK=______________��
(3)����(2)�з�Ӧ�ɲⶨ��As2O3��As2O5�������еĸ���ֺ���(�������ʶԲⶨ��Ӱ��)���������£�
�ٽ�����02000g����NaOH��Һ���õ���AO33-��AsO43-�Ļ����Һ��
���������Һ��0.02500 mol��L-1��I2��Һ�ζ����õ�����Һ��ָʾ������________________����ζ��ﵽ�յ㡣�ظ��ζ�3�Σ�ƽ������I2��Һ40.00mL����������As2O5������������_________(������λ��Ч����)�����ζ��յ�ʱ�����Ӷ�������������_________ (�ƫ�͡�����ƫ�ߡ�������Ӱ�족)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������˻ᡰ���ơ����ȼ���DZ��飨C3H8��������������˻���ȼ���DZ�ϩ��C3H6����
��1����������ɵñ�ϩ�� ��֪��C3H8��g��=CH4��g��+HC��CH��g��+H2��g������H1=+156.6kJmol��1
CH3CH=CH2��g��=CH4��g��+HC��CH��g������H2=+32.4kJmol��1
����ͬ�����£���ӦC3H8��g��=CH3CH=CH2��g��+H2��g���ġ�H=kJmol��1
��2���Ա���Ϊȼ����������ȼ�ϵ�أ���ص�����ͨ��O2��CO2 �� ����ͨ����飬�����������̼���Σ�����ܷ�Ӧ����ʽ���ŵ�ʱ��CO32�������ص� �����������������
��3��̼�⻯������ȫȼ������CO2��H2O�����³�ѹ�£������е�CO2����ˮ���ﵽƽ��ʱ����Һ��pH=5.60��c��H2CO3��=1.5��10��5 mol/L��������ˮ�ĵ��뼰H2CO3�ĵڶ������룬��H2CO3HCO3��+H+��ƽ�ⳣ��K1= �� ����֪��10��5.60=2.5��10��6��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϸ����ˮ����Ҫ�����ǣ�������
��������������ܼ�
������Ӫ�����ʺʹ�л����
�۾���ϸ����̬
��ά���������ӵĿռ�ṹ
A. �٢ڢ� B. �ڢۢ� C. �٢ڢ� D. �٢ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͬһ����A��BԪ���γɻ�����AB2��A��Bԭ�������IJ������(����)
A.1B.2C.3D.5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ������˵����ȷ����
A. �ɱ�����Ҫ�ɷ���H2O B. ����CO�ɵ��������ж�
C. SO2�ɴ�������Ư��ʳƷ D. С�մ����Ҫ�ɷ���Na2CO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ�����ǽ�����ҵ���õ�ճ�ϼ�����������ľ�ķ���ͷ���������ˮ����Ϊ
A. CaSiO3���� B. SiO2
C. Na2SiO3ˮ��Һ D. H2SiO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����н϶�Ca2+��Mg2+��HC![]() O3-��ˮ��Ϊ��ʱӲˮ�����ȿɳ�ȥCa2+��Mg2+ �� ʹˮ��Ϊ��ˮ������һ��¯��ʹ������ˮ�����ж���ˮ������Ҫ�ɷ�Ϊ���� ���� ����֪Ksp��MgCO3��=6.8��10��6 �� Ksp[Mg��OH��2]=5.6��10��12��
O3-��ˮ��Ϊ��ʱӲˮ�����ȿɳ�ȥCa2+��Mg2+ �� ʹˮ��Ϊ��ˮ������һ��¯��ʹ������ˮ�����ж���ˮ������Ҫ�ɷ�Ϊ���� ���� ����֪Ksp��MgCO3��=6.8��10��6 �� Ksp[Mg��OH��2]=5.6��10��12��
A.CaO��MgO
B.CaCO3��MgCO3
C.CaCO3��Mg��OH��2
D.CaCO3��MgO
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com