
【题目】随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。
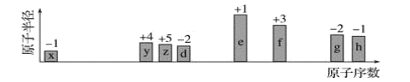
根据判断出的元素回答问题:
(1)f在周期表中的位置是________。
(2)比较d、e常见离子的半径大小(用化学式表示,下同):________>________;比较g、h的最高价氧化物对应水化物的酸性强弱________>________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式:_________________________。
(4)e的单质在足量![]() 中燃烧的化学方程式:_________________________。
中燃烧的化学方程式:_________________________。
(5)上述元素可组成盐![]() 。向盛有
。向盛有![]() 溶液的烧杯中滴加
溶液的烧杯中滴加![]() 溶液,沉淀物质的量随
溶液,沉淀物质的量随![]() 溶液体积的变化示意图如下:
溶液体积的变化示意图如下:
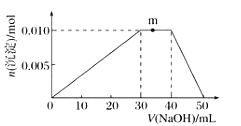
①R溶液的电离方程式____________________________。
②写出m点反应的离子方程式:____________________。
③若在R溶液中改加![]() 溶液,充分反应后,溶液中产生沉淀的物质的量为________
溶液,充分反应后,溶液中产生沉淀的物质的量为________![]() 。
。
【答案】第三周期ⅢA族 ![]()
![]()
![]()
![]()
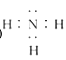 (或
(或![]() 等其他合理答案均可)
等其他合理答案均可) ![]() NH4Al(SO4)2=NH4++Al3++2SO42-
NH4Al(SO4)2=NH4++Al3++2SO42- ![]() 0.022
0.022
【解析】
从图中的化合价、原子半径的大小及原子序数,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素;
(1)f是Al元素,原子核外有3个电子层,最外层电子数为3,据此判断f在在元素周期表的位置;
(2)电子层结构相同的离子,离子半径随着原子序数增大而减小;同一周期元素,非金属性随着原子序数增大而增强;
(3)任选上述元素组成一种四原子共价化合物,如氨气等;
(4)e为Na、d为O,Na在氧气中燃烧生成Na2O2;
(5)(5)①NH4Al(SO4)2在溶液中电离出NH4+、Al3+和SO42-;
②m点过程中加入氢氧化钠,沉淀物质的量不变,是NH4+与OH-反应生成NH3H2O;
③根据n=cV计算n(Al3+ )、n(NH4+)、n(SO42-)、n(Ba2+)、n(OH-),根据SO42-、Ba2+中不足量的离子的物质的量计算生成BaSO4的物质的量,依次发生:Al3++OH-=Al(OH)3↓、NH4++OH-=NH3H2O、Al(OH)3+OH-=AlO2-+2H2O,根据方程式计算生成Al(OH)3的物质的量,进而二者计算生成固体总物质的量。
从图中的化合价、原子半径的大小及原子序数,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素;
(1)f是Al元素,原子核外有3个电子层,最外层电子数为3,在元素周期表的位置是第3周期ⅢA族;
(2)电子层结构相同的离子,离子半径随着原子序数增大而减小,则离子半径:O 2->Na+;同一周期元素,非金属性随着原子序数增大而增强,则非金属性S<Cl,故最高价氧化物对应水化物的酸性强弱关系为HClO4>H2SO4;
(3)任选上述元素组成一种四原子共价化合物,如氨气等,氨气电子式为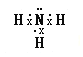 ;
;
(4)e为Na、d为O,Na在氧气中燃烧生成Na2O2,发生反应的化学方程式为2Na + O2 ![]() Na2O2;
Na2O2;
(5)①NH4Al(SO4)2在溶液中电离出NH4+、Al3+和SO42-,则电离方程式为NH4Al(SO4)2=NH4++Al3++2SO42-;
p>②m点过程中加入氢氧化钠,沉淀物质的量不变,是NH4+与OH-反应生成NH3H2O,离子方程式为:NH4++OH-=NH3H2O;③10mL 1molL-1 NH4Al(SO4)2溶液中Al3+ 物质的量为0.01mol,NH4+的物质的量为0.01mol,SO42-的物质的量为0.02mol,20mL 1.2 molL-1Ba(OH)2溶液中Ba2+物质的量为0.024mol,OH-为0.048mol;
由SO42-+Ba2+=BaSO4↓,可知SO42-不足,故可以得到0.02mol BaSO4,
Al3++3OH-=Al(OH)3↓
0.01mol 0.03mol 0.01mol
反应剩余OH-为0.048mol-0.03mol=0.018mol,
NH4++OH-=NH3H2O
0.01mol 0.01mol
反应剩余OH-为0.018mol-0.01mol=0.008mol,
Al(OH)3+OH-=AlO2-+2H2O
0.008mol 0.008mol
故得到Al(OH)3沉淀为0.01mol-0.008mol=0.002mol
则最终得到固体为0.02mol+0.002mol=0.022mol。


科目:高中化学 来源: 题型:
【题目】Zn3(PO4)2·2H2O(溶于酸,难溶于水)是一种无毒害作用的防锈颜料,利用锌浮渣(主要含Zn、ZnO、ZnCl2,还含少量的铁、锰、铜、铅及砷的化合物等)制取Zn3(PO4)2·2H2O的工艺流程如图:
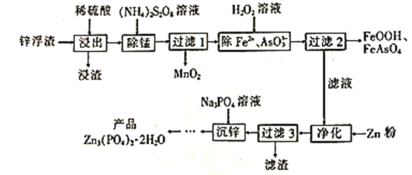
回答下列问题:
(1)“浸出”时,下列措施能提高锌的浸取率的是__(填字母)。
A.用浓硫酸代替稀硫酸 B.适当升高浸取液的温度
C.将“浸渣”再次浸取 D.缩短“浸出”时间
(2)“除锰”时,Mn2+发生反应的离子方程式为__(S2O![]() 被还原为SO
被还原为SO![]() )。
)。
(3)流程中除铁、砷时,当生成8.9gFeOOH和7.8gFeAsO4时,消耗H2O2__mol。
(4)“净化”时加锌粉的目的是__。
(5)“沉锌”时发生反应的化学方程式为__。
(6)“沉锌”至得到“产品”还需要经过的操作是__、洗涤、__。证明产品已洗涤干净的实验方法是__。
(7)Meyer等认为磷酸锌防腐机理是在钢铁表面形成组成近似为Zn2Fe(PO4)2·4H2O的覆盖膜,则在形成该覆盖膜的过程中,负极的电极反应式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微信热传的“苯宝宝表情包”可看作是由苯衍生的物质配以相应文字形成的(如图)。下列说法正确的是

A. 化合物(A)不能与乙醇发生反应
B. 化合物(B)分子式为C6H6Cl6
C. 化合物(B)可通过苯与Cl2发生加成反应制得
D. 1mol化合物(A)可与3molH2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在石蜡油的分解实验中,产物可使酸性高锰酸钾溶液褪色,也可以使溴的四氯化碳溶液褪色。

请你根据实验过程及现象探讨下列问题:
(1)碎瓷片的作用是__。
(2)分解产物中的气体是否都是烷烃__,你的依据是__。
(3)证明石蜡油分解产物中含有碳、氢元素的方法是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲利用浓盐酸、MnO2、Fe等试剂制取无水氯化铁、收集一定量的氯气并验证其某些性质,实验装置如图所示(制气装置省略)。下列说法错误的是

A.④中a导管应向下延伸至接近瓶底
B.若撤去⑥,则⑤中可能有Fe2O3生成
C.当⑤中充满黄绿色气体时再点燃⑤处酒精灯
D.③中试纸若是湿润的,则根据产生的现象可证明氯气有酸性,漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 CO2的资源化利用一直是化学家们关注的重要课题,中科院大连化学物理研究所设计了一种新型多功能复合催化剂,成功地实现了CO2直接加氢制取高辛烷值汽油:![]() (反应①),该研究成果被评价为“CO2催化转化领域的突破性进展”。
(反应①),该研究成果被评价为“CO2催化转化领域的突破性进展”。
(1)已知氢气的燃烧热为![]() ,若要利用
,若要利用![]() 的燃烧热求a的值,则还需要知道一个反应的
的燃烧热求a的值,则还需要知道一个反应的![]() ,该反应是________________________________。反应①在一定条件下具有自发性,则a_______________0(填“>”或“<”)。
,该反应是________________________________。反应①在一定条件下具有自发性,则a_______________0(填“>”或“<”)。
(2)向某密闭容器中按一定投料比充入![]() 、
、![]() ,控制条件使其发生反应:
,控制条件使其发生反应:![]() 。测得
。测得![]() 的平衡转化率与温度、压强之间的关系如图1所示:
的平衡转化率与温度、压强之间的关系如图1所示:
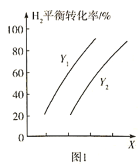
则X表示______________,![]() ___________
___________![]() (填“>”或“<”)。欲提高
(填“>”或“<”)。欲提高![]() 的平衡转化率并提高单位时间内
的平衡转化率并提高单位时间内![]() 的产量,可采取的措施是______________________(填两种)。
的产量,可采取的措施是______________________(填两种)。
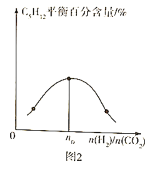
(3)控制一定温度、催化剂,按不同投料比![]() 将反应物通入到某密闭容器中,测得平衡时
将反应物通入到某密闭容器中,测得平衡时![]() 的百分含量与投料比之间的关系如图2所示,则
的百分含量与投料比之间的关系如图2所示,则![]() ____________。
____________。
(4)在钌-铑双金属催化剂的作用下,CH3OH、CO2、H2可高效地转化为乙酸,反应方程式为![]() 。一定温度下,向某刚性容器中通入等物质的量的三种原料气,测得体系中的总压强与时间的关系如下表所示:
。一定温度下,向某刚性容器中通入等物质的量的三种原料气,测得体系中的总压强与时间的关系如下表所示:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
p/kPa | 3 | 2.7 | 2.5 | 2.35 | 2.26 | 2.2 | 2.2 |
则反应开始到达到平衡的过程中,![]() ______________
______________![]() ______________
______________![]() 。
。
(5)碳捕捉技术的发展也有利于CO2在资源应用方面得到充分利用。常温下,若某次用NaOH溶液捕捉空气中的CO2所得溶液的pH=10,并测得溶液中![]() ,则
,则![]() _____________
_____________![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,水溶液中H+和OH-的浓度变化曲线如图。下列说法正确的是( )
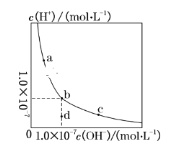
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-14
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管中开始放入几小块镁片,再滴入5mL稀盐酸。
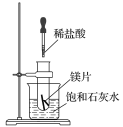
回答下列问题:
(1)实验中观察到的现象是________________。
(2)产生上述现象的原因是________________。
(3)写出有关反应的离子方程式____________。
(4)由实验推知,MgCl2溶液和H2的总能量________(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示。下列说法中正确的是( )
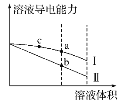
A.两溶液稀释前的浓度相同
B.a、b、c三点溶液的pH由大到小顺序为a>b>c
C.a点的Kw值比b点的Kw值大
D.a点水电离的c(H+)大于c点水电离的c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com