
����Ŀ�� CO2����Դ������һֱ�ǻ�ѧ���ǹ�ע����Ҫ���⣬�п�Ժ������ѧ�����о��������һ�����Ͷ�ܸ��ϴ������ɹ���ʵ����CO2ֱ�Ӽ�����ȡ������ֵ���ͣ�![]() (��Ӧ��)�����о��ɹ�������Ϊ��CO2��ת�������ͻ���Խ�չ����
(��Ӧ��)�����о��ɹ�������Ϊ��CO2��ת�������ͻ���Խ�չ����
(1)��֪������ȼ����Ϊ![]() ����Ҫ����
����Ҫ����![]() ��ȼ������a��ֵ������Ҫ֪��һ����Ӧ��
��ȼ������a��ֵ������Ҫ֪��һ����Ӧ��![]() ���÷�Ӧ��________________________________����Ӧ����һ�������¾����Է��ԣ���a_______________0(����>������<��)��
���÷�Ӧ��________________________________����Ӧ����һ�������¾����Է��ԣ���a_______________0(����>������<��)��
(2)��ij�ܱ������а�һ��Ͷ�ϱȳ���![]() ��
��![]() ����������ʹ�䷢����Ӧ��
����������ʹ�䷢����Ӧ��![]() �����
�����![]() ��ƽ��ת�������¶ȡ�ѹǿ֮��Ĺ�ϵ��ͼ1��ʾ��
��ƽ��ת�������¶ȡ�ѹǿ֮��Ĺ�ϵ��ͼ1��ʾ��
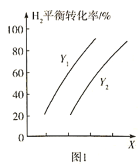
��X��ʾ______________��![]() ___________
___________![]() (����>������<��)�������
(����>������<��)�������![]() ��ƽ��ת���ʲ���ߵ�λʱ����
��ƽ��ת���ʲ���ߵ�λʱ����![]() �IJ������ɲ�ȡ�Ĵ�ʩ��______________________(������)��
�IJ������ɲ�ȡ�Ĵ�ʩ��______________________(������)��
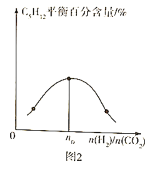
(3)����һ���¶ȡ�����������ͬͶ�ϱ�![]() ����Ӧ��ͨ�뵽ij�ܱ������У����ƽ��ʱ
����Ӧ��ͨ�뵽ij�ܱ������У����ƽ��ʱ![]() �İٷֺ�����Ͷ�ϱ�֮��Ĺ�ϵ��ͼ2��ʾ����
�İٷֺ�����Ͷ�ϱ�֮��Ĺ�ϵ��ͼ2��ʾ����![]() ____________��
____________��
(4)����-��˫���������������£�CH3OH��CO2��H2�ɸ�Ч��ת��Ϊ���ᣬ��Ӧ����ʽΪ![]() ��һ���¶��£���ij����������ͨ������ʵ���������ԭ�����������ϵ�е���ѹǿ��ʱ��Ĺ�ϵ���±���ʾ��
��һ���¶��£���ij����������ͨ������ʵ���������ԭ�����������ϵ�е���ѹǿ��ʱ��Ĺ�ϵ���±���ʾ��
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
p/kPa | 3 | 2.7 | 2.5 | 2.35 | 2.26 | 2.2 | 2.2 |
��Ӧ��ʼ���ﵽƽ��Ĺ����У�![]() ______________
______________![]() ______________
______________![]() ��
��
(5)̼�������ķ�չҲ������CO2����ԴӦ�÷���õ�������á������£���ij����NaOH��Һ�������е�CO2������Һ��pH=10���������Һ��![]() ����
����![]() _____________
_____________![]() ��
��
���𰸡�![]() < ѹǿ < ����ѹǿ������
< ѹǿ < ����ѹǿ������![]() 3.2 0.032 80
3.2 0.032 80 ![]()
��������
(1)���ݸ�˹���ɷ���������G=��H-T��S<0ʱ��Ӧ�����Է����У�
(2)�÷�ӦΪ���ȷ�Ӧ����XΪ�¶ȣ����¶�����ƽ�������ƶ���������ת����Ӧ��С����ͼ�β���������XΪѹǿ��YΪ�¶ȣ�
(4)���������У�����ķ�ѹ֮�ȵ������ʵ���֮�ȣ����Կ���ѹǿ��ЧΪ���ʵ��������м��㣬���Բ������ʼͶ��ΪCH3OH��CO2��H2��Ϊ1mol����ƽ��ʱ����������ʵ���Ϊ2.2mol����ƽ��ʱ�������ʵ�ת����Ϊx����������ʽ��
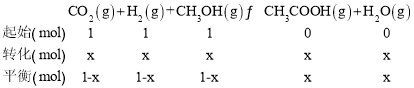
����3(1-x)+2x=2.2mol�����x=0.8mol��
(1)��ʾ����ȼ���ȵ��Ȼ�ѧ����ʽΪH2(g)+![]() O2(g)=H2O(l)��H �ڣ�
O2(g)=H2O(l)��H �ڣ�
����֪��Ӧ![]() �٣�
�٣�
��-����16�ɵ÷�Ӧ![]() �����ݸ�˹��֪����֪���÷�Ӧ���ʱ䣬������Ӧ�ٵ��ʱ䣻����G=��H-T��S<0ʱ��Ӧ�����Է����У��÷�ӦΪ������ٵķ�Ӧ�����ԡ�S<0����Ҫ�����H-T��S<0���H����С��0��
�����ݸ�˹��֪����֪���÷�Ӧ���ʱ䣬������Ӧ�ٵ��ʱ䣻����G=��H-T��S<0ʱ��Ӧ�����Է����У��÷�ӦΪ������ٵķ�Ӧ�����ԡ�S<0����Ҫ�����H-T��S<0���H����С��0��
(2)���ݷ�����֪X��ʾѹǿ��Y��ʾ�¶ȣ���ͬѹǿ�£��¶�Խ��������ת����ԽС������Y1<Y2�����������̼��Ũ�ȿ���ʹƽ�������ƶ����ҷ�Ӧ��������λʱ����C5H12(l)�IJ������÷�ӦΪ���������С�ķ�Ӧ����С�������ѹǿҲ����ʹƽ�������ƶ���ͬʱ����Ӧ���ʣ������¶ȡ���ʱ������������Ȼ��ʹƽ�������ƶ�������ʹ��Ӧ���ʼ�С�������������Բ�ȡ�Ĵ�ʩ������ѹǿ������![]() ��
��
(3)���ڿ��淴Ӧ������Ӧ���Ͷ�ϱ��������֮�����ʱ�������ƽ��ٷֺ����������n0=![]() =3.2��
=3.2��
(4)���ݱ������ݿ�֪25minʱ��Ӧ�ﵽƽ�⣬��Ϸ�����֪��ʱ���ڡ�p(CO2)=0.8kPa������v(CO2)=![]() =0.032kPa/min����Ϸ�����֪ƽ��ʱp(CO2)= p(CH3OH)= p(H2)=0.2kPa��p(H2O)= p(CH3COOH)=0.8kPa������Kp=
=0.032kPa/min����Ϸ�����֪ƽ��ʱp(CO2)= p(CH3OH)= p(H2)=0.2kPa��p(H2O)= p(CH3COOH)=0.8kPa������Kp=![]() =80kPa-1��
=80kPa-1��
(5)Ka2(H2CO3)=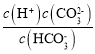 ��
��![]() ʱ��pH=10����c(H+)=10-10mol/L������Ka2(H2CO3)=0.5��10-10=5��10-11��
ʱ��pH=10����c(H+)=10-10mol/L������Ka2(H2CO3)=0.5��10-10=5��10-11��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������{[CH3CH��OH��COO]2Fe3H2O}��һ�ֺܺõ�ʳƷ��ǿ������������ˮ������Ч���������ã�����������FeCO3 ��Ӧ�Ƶã�2CH3CH��OH��COOH+FeCO3+2H2O��[CH3CH��OH��COO]2Fe3H2O+CO2����
���Ʊ�FeCO3��װ����ͼ��ʾ��
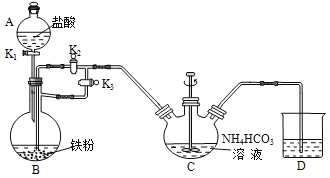
��1��B��������____��
��2������ϴ���������װ�������Եķ����ǣ���D������ĩ�����ϼ�ֹˮ�е��ܣ���A�м���ˮ���ֱ����K1��K3���رջ���K2�����۲쵽___�������������á�
�ڵ���A�е�ˮ���������ᣬ��B�м������ۡ�C�м���NH4HCO3��Һ���رջ���K2������K1��K3��������������رջ���K1����������������Ӧһ��ʱ���رջ���K3������K2��C�з����ķ�Ӧ�����ӷ���ʽΪ____��
���Ʊ������������壺���Ƶõ�FeCO3����������Һ�У������������ۣ���75���½���ʹ֮��ַ�Ӧ��Ȼ���ټ����������ᡣ
��3�������������۵�������___����������Һ�л�������������������ʵ������ǣ���������������������ȴ�ᾧ��____��ϴ�ӡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ��һ����Ҫ�Ļ���ԭ�ϡ����ɱ���������Ʊ���
����Ӧ����C3H8(g)=C3H6(g)+H2(g) ��H1
����Ӧ����C3H8(g)=C2H4(g)+CH4(g)
��C2H4(g)+H2(g)=C2H6(g)
��C3H8(g)+H2(g)=C2H6(g)+CH4(g)
�ش��������⣺
��1����֪��C3H8(g)+![]() O2(g)=C3H6(g)+H2O(g) ��H2=��117kJ/mol
O2(g)=C3H6(g)+H2O(g) ��H2=��117kJ/mol
H2(g)+![]() O2(g)=H2O(g) ��H3=��242kJ/mol����Ӧ�ٵ���H1=___��
O2(g)=H2O(g) ��H3=��242kJ/mol����Ӧ�ٵ���H1=___��
��2��ij�¶��£������������ܱ������ڷ�����Ӧ�٣���ʼ��ѹǿΪ105Pa��ƽ��ʱ��ѹ������20%����C3H8��ת����Ϊ___���÷�Ӧ��ƽ�ⳣ��Kp=___Pa�������C3H8��ƽ��ת���ʣ��ɲ�ȡ�Ĵ�ʩ��___�����ţ���
A.����C3H8��Ũ��
B.����¶�
C.������ͨ���������
D.ʹ�ø�Ч����
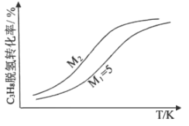
��3����ҵ�����г����ú�ѹ�³������ˮ��������������ͼ��ʾ��ѹ�·�Ӧ��C3H8��ƽ��ת�������¶ȼ�ˮ���ȣ�M���Ĺ�ϵ��M2___5������>������<������
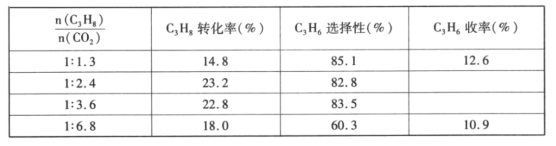
��4����֪������C��C�����ѷ�Ӧ��C��H�����ѵ����ⷴӦ���������⽫���±�ϩѡ���Խ��ͣ�ͬʱ���¼Ӿ���������̿�����´���Ѹ��ʧ��������г���CO2������֮һ�����ڴ������Ա��֣���ԭ����___����Ӧ����![]() ����ȶԴ������Ե�Ӱ�������ʾ������C3H6�������ʱ
����ȶԴ������Ե�Ӱ�������ʾ������C3H6�������ʱ![]() �������___��
�������___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ժʿ�Ŷ��ھ��θ�Ⱦ����״�������߹����У����ִ�«��Τ���¹ڲ�����һ�����������á������йظ����ʵ�˵����ȷ����
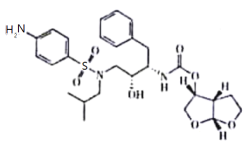
A.���б��������ڷ�����
B.�����ϵ�һ����������5��ͬ���칹��
C.1 mol�������������7 mol H2�����ӳɷ�Ӧ
D.��������ˮ������Һ������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ԭ���������������ֶ�����Ԫ�أ�����ĸx�ȱ�ʾ��ԭ�Ӱ뾶����Դ�С��������ۻ�����۵ı仯��ͼ��ʾ��
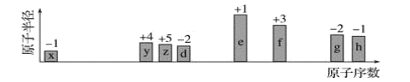
�����жϳ���Ԫ�ػش����⣺
��1��f�����ڱ��е�λ����________��
��2���Ƚ�d��e�������ӵİ뾶��С���û�ѧʽ��ʾ����ͬ����________>________���Ƚ�g��h������������Ӧˮ���������ǿ��________>________��
��3����ѡ����Ԫ�����һ����ԭ�ӹ��ۻ����д�������ʽ��_________________________��
��4��e�ĵ���������![]() ��ȼ�յĻ�ѧ����ʽ��_________________________��
��ȼ�յĻ�ѧ����ʽ��_________________________��
��5������Ԫ�ؿ������![]() ����ʢ��
����ʢ��![]() ��Һ���ձ��еμ�
��Һ���ձ��еμ�![]() ��Һ���������ʵ�����
��Һ���������ʵ�����![]() ��Һ����ı仯ʾ��ͼ���£�
��Һ����ı仯ʾ��ͼ���£�
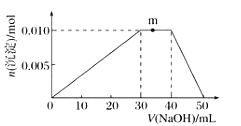
��R��Һ�ĵ��뷽��ʽ____________________________��
��д��m�㷴Ӧ�����ӷ���ʽ��____________________��
������R��Һ�иļ�![]() ��Һ����ַ�Ӧ����Һ�в������������ʵ���Ϊ________
��Һ����ַ�Ӧ����Һ�в������������ʵ���Ϊ________![]() ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ա�����ѧ��������Ϊ�����Ķ���Ŷӣ��з����˸�Ч����������![]() ��
��![]() ��
��![]() ��
��![]() �����кϳɴ�������
�����кϳɴ�������![]() ��
��![]() Ϊԭ�Ͽɸ߲��ʺϳ�ϩ������������
Ϊԭ�Ͽɸ߲��ʺϳ�ϩ������������![]() ��
��![]() ��Ϊú��������Һ��ʹ�ÿ�������;����
��Ϊú��������Һ��ʹ�ÿ�������;����
��![]() ��������ߵ��ܼ��ϵĵ�������__________����չ����λ�ڲ�ͬ�������˶��ĵ��ӵ�������С��ϵ��_______________����
��������ߵ��ܼ��ϵĵ�������__________����չ����λ�ڲ�ͬ�������˶��ĵ��ӵ�������С��ϵ��_______________����![]() ԭ�ӵ����Ų���
ԭ�ӵ����Ų���![]() ʱ����ϵ������_________������������������С������
ʱ����ϵ������_________������������������С������
��![]() ��C��O����Ԫ�صĵ�һ�������ɴ�С��˳��Ϊ___________��
��C��O����Ԫ�صĵ�һ�������ɴ�С��˳��Ϊ___________��![]() ������̼ԭ�ӵ��ӻ��������Ϊ________________�����������Ӧ��
������̼ԭ�ӵ��ӻ��������Ϊ________________�����������Ӧ��![]() �����ж��ѵĻ�ѧ������Ϊ__________������ĸ����
�����ж��ѵĻ�ѧ������Ϊ__________������ĸ����
A��2��������1��![]() ��B��1��������2��
��B��1��������2��![]() ��C���Ǽ��Լ�
��C���Ǽ��Լ�
��������![]() ������5��̼ԭ���γɵĿռ乹����_______________���÷�����________�����������������Ǽ����������ӡ�������������̼ԭ����Ŀ�����ӣ�ͬϵ��ķе����ߣ���ԭ����_________��
������5��̼ԭ���γɵĿռ乹����_______________���÷�����________�����������������Ǽ����������ӡ�������������̼ԭ����Ŀ�����ӣ�ͬϵ��ķе����ߣ���ԭ����_________��
��̼����֮����γɶ��ֻ��������һ�ֻ�����ľ���ṹ�����������ṹ����ͼ��ʾ��

����Ϊ����ԭ�ӵ�����Ϊ_____________���û�����Ļ�ѧʽΪ_____________����þ���ľ�������Ϊ![]() �������ӵ�������ֵΪ
�������ӵ�������ֵΪ![]() ����þ�����ܶ�Ϊ____________________
����þ�����ܶ�Ϊ____________________![]() ���г�����ʽ���ɣ���
���г�����ʽ���ɣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪25 ��ʱ0.1 mol��L��1������Һ��pHԼΪ3�������м�������ƾ��壬�Ⱦ����ܽ������Һ��pH�����������������ֲ�ͬ�Ľ��ͣ���ͬѧ��Ϊ������ˮ��ʼ��ԣ�������c(OH��)�������Һ��pH������ͬѧ��Ϊ����������ˮ�����������������ӣ������˴���ĵ��룬ʹc(H��)��С�������Һ��pH����
(1)�������ֽ�����________(����������������)��ȷ��
(2)Ϊ����֤�������ֽ�����ȷ������������ʵ�飺��0.1 mol��L��1�Ĵ�����Һ�м����������������е�________(��д�����ĸ)��Ȼ��ⶨ��Һ��pH��
A������CH3COOK | B������CH3COONH4 |
C������NH3 | D������NaHCO3 |
(3)��________(����������������)�Ľ�����ȷ����Һ��pHӦ________(����������������С������������)(��֪25 �� ʱ��CH3COONH4��Һ������)��
(4)�����½�0.010 mol CH3COONa��0.004 mol HCl����ˮ�����Ƴ�0.5 L�����Һ���жϣ�
����Һ�й���________�����ӡ�
����Һ�����������ӵ����ʵ����ĺ�һ������0.010 mol��������________��________��
����Һ��n(CH3COO��)��n(OH��)��n(H��)��________mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧΪ��̽��ԭ��ز��������Ĺ��̣��������ͼ��ʾʵ�顣
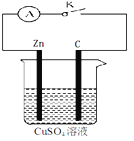
��1����K���۲쵽������Ϊ ��
��2���ر�K���۲쵽�������� ��
�˵�صĸ����ĵ缫��ӦʽΪ ��
�ܷ�ӦʽΪ ��
��3���ر�K����Һ���������� ����Zn��C�����˶���
���·�У��������������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�����еĶ�������͵��������Ǵ�����Ҫ��Ⱦ������ѵ��ǻ����������ȵ����⡣�ش��������⣺
��1����֪�����仯��������·�Ӧ��
N2(g)+O2(g)![]() 2NO(g) ��H=+180kJ��mol-1
2NO(g) ��H=+180kJ��mol-1
N2(g)+2O2(g)![]() 2NO2(g) ��H=+68kJ��mol-1
2NO2(g) ��H=+68kJ��mol-1
��2NO(g)+O2(g)![]() 2NO2(g)��H___kJ��mol-1��
2NO2(g)��H___kJ��mol-1��
��2������KMnO4�ѳ�������������ӷ���ʽΪ��___
�١�MnO![]() +��SO2+��H2O
+��SO2+��H2O![]() ��MnO
��MnO![]() +�� +�� ������������������ϵ��������__�������������ţ�
+�� +�� ������������������ϵ��������__�������������ţ�
����������Ӧ�м���CaCO3�������SO2ȥ���ʣ�ԭ����___��
��3��CaSO3��Na2SO4��Ͻ�Һ�������ѳ�NO2����Ӧ����Ϊ��
I.CaSO3(s)+SO![]() (aq)
(aq)![]() CaSO4(s)+SO
CaSO4(s)+SO![]() (aq)
(aq)
II.SO![]() (aq)+2NO2(g)+H2O(l)
(aq)+2NO2(g)+H2O(l)![]() SO
SO![]() (aq)+2NO
(aq)+2NO![]() (aq)+2H+(aq)
(aq)+2H+(aq)
��Һ��CaSO3����һ��ʱ��Na2SO4��������NO2��ȥ���ʱ仯������ͼ��ʾ��

a���NO2ȥ���ʽ��͵�ԭ����___��
��4������̵�����NOx�����IJ������£�
I.��VL����ͨ�������ữ��H2O2��Һ�У�ʹNOx��ȫ������ΪNO![]() ��
��
II.��ˮϡ����100.00mL����ȡ20.00mL����Һ����V1mLc1mol��L-1FeSO4����Һ����������ֻ�ϣ�
III.��c2mol��L-1KMnO4����Һ�ζ�ʣ���Fe2+���յ�ʱ����V2mL��
��NO��H2O2����ΪNO![]() �����ӷ���ʽΪ___��
�����ӷ���ʽΪ___��
�ڵζ���������Ҫʹ�õIJ���������___����ƿ�ȡ�
�۵ζ������з������з�Ӧ��
3Fe2++NO+4H+=NO��+3Fe3++2H2O
MnO![]() +5Fe2++8H+=Mn2++5Fe3++4H2O
+5Fe2++8H+=Mn2++5Fe3++4H2O
����������NOx�ۺϳ�NO2�ĺ���Ϊ__mg��m-3��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com