
����Ŀ����֪���ֶ�����Ԫ�أ�A��B��C��D��E�ĺ˵����������������B��Eͬ���壬AԪ�ص��⻯���DZ���Ϊ��Ч���ϴ�����ȼ�ϣ�BԪ���ǵؿ��к�������Ԫ�أ�C��D��E����ԭ�ӵ�������Ӳ������֮��Ϊ10����������Ԫ�ص�����������Ӧˮ����֮���������ܷ�Ӧ���������κ�ˮ��
��1���ƶ�A��B��C��D��E����Ԫ�أ�д������Ԫ�����ƣ�
B��________ C��________ E��_________
��2��C2E����������Ϊ_____________��
��3��д��������AB2�ĵ���ʽ_____________
��4��д��D�ĵ�����E������������ˮ�����ϡ��Һ��Ӧ�����ӷ���ʽΪ
_____________________________________________��
���𰸡� �� �� �� ���� ![]() 2Al + 6H+ =2Al3+ + 3H2��
2Al + 6H+ =2Al3+ + 3H2��
�����������ֶ�����Ԫ�أ�A��B��C��D��E�ĺ˵������������BԪ���ǵؿ��к�������Ԫ�أ���BΪ��Ԫ�أ�B��Eͬ���壬��EΪ��Ԫ�أ�AԪ�ص��⻯���DZ���Ϊ��Ч���ϴ�����ȼ�ϣ���AΪ̼Ԫ�أ�C��D��E����Ԫ�ص�����������Ӧˮ����֮���������ܷ�Ӧ���������κ�ˮ��Ϊ����������ǿ�ǿ��ķ�Ӧ����Ԫ�ض����ڵ������ڣ���CΪNaԪ�ء�DΪAlԪ�أ�����ԭ�ӵ�������Ӳ������֮��Ϊ10��
(1)������������֪��BΪ����CΪ�ơ�EΪ��
(2)C2E�����ﻯѧʽΪNa2S����ѧ����Ϊ���ƣ�
(3)������AB2ΪCO2�������ʽΪ![]() ��
��
(4)E������������ˮ����ΪH2SO4��Al��ϡ���ᷴӦ��������������������Ӧ�����ӷ���ʽΪ2Al+6H+=2Al3++3H2����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ɣ�ij��Ԫ��(��ѧʽ��H2A��ʾ)��ˮ�еĵ��뷽��ʽ�ǣ�H2A �� H�� �� HA����HA��![]() H����A2�����ش��������⣺
H����A2�����ش��������⣺
��1����0.1mol��L��1��Na2A��Һ�У�������Ũ�ȹ�ϵ����ȷ����_________��
A��c(A2��)��c(HA��)��c(H2A)��0.1mol��L��1
B��c(OH��)��c(H��)��c(HA��)
C��c(Na��)��c(H��)��c(OH��)��c(HA��)��2c(A2��)
D��c(Na��)��2c(A2��)��2c(HA��)
��2����֪0.1mol��L��1NaHA��Һ��pH��2����0.1mol��L��1H2A��Һ�������ӵ����ʵ���Ũ��________(�����������������)0.11mol��L��1��
II��������(H3PO3)�Ƕ�Ԫ�ᣬH3PO3��Һ���ڵ���ƽ�⣺H3PO3![]() H+ +H2PO3����������������NaOH��Һ��Ӧ������Na2HPO3��
H+ +H2PO3����������������NaOH��Һ��Ӧ������Na2HPO3��
��1����ij�¶��£�0.1000 mol��L-1��H3PO3��Һ��c (H+) = 2.5��10����mol��L-1����OH-֮���������ӵ�Ũ���ɴ�С��˳���� ��
��д��������������NaOH��Һ��Ӧ�����ӷ���ʽ ��
III������̼���á�ʱ������ѧ�����á����ת�����ȼ�����CO2�����ۺ����á�
��1��CO2��H2��һ�������¿���������ϩ��6H2(g)+2CO2(g)![]() CH2==CH2(g)+4H2O(g) ��H=a kJ��mol-1 ��֪��H2(g)��ȼ����Ϊ285.8 kJ��mol-1��CH2=CH2(g)��ȼ����Ϊ1411.0 kJ��mol-1��H2O(g)= H2O(l) ��H=-44.0 kJ��mol-1����a=______kJ��mol-1��
CH2==CH2(g)+4H2O(g) ��H=a kJ��mol-1 ��֪��H2(g)��ȼ����Ϊ285.8 kJ��mol-1��CH2=CH2(g)��ȼ����Ϊ1411.0 kJ��mol-1��H2O(g)= H2O(l) ��H=-44.0 kJ��mol-1����a=______kJ��mol-1��
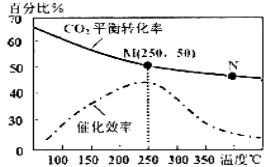
��2������������ϩ�ķ�Ӧ�У��¶ȶ�CO2��ƽ��ת���ʼ������Ĵ�Ч��Ӱ��������ͼ�������й�˵������ȷ����_______(�����)
���¶�Խ�ߣ������Ĵ�Ч��Խ��
��M��ƽ�ⳣ����N��ƽ�ⳣ����
���¶ȵ���250��ʱ�������¶����ߣ���ϩ�IJ�������
������ѹǿ�������ϩ���������
��N������Ӧ����һ������M������Ӧ����
IV��Ϊ���������Ⱦ����������β���ŷŴ���װ��ת��װ�ã���Ӧ����ʽΪ��
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)��
2CO2(g)+N2(g)��
��3������500��ʱ��Ͷ��![]() =1 ��NO����ʼŨ��Ϊamol/L,NO��ת����Ϊ80��������¶�ʱ��ƽ�ⳣ��K=________��
=1 ��NO����ʼŨ��Ϊamol/L,NO��ת����Ϊ80��������¶�ʱ��ƽ�ⳣ��K=________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�0.1molL-1ijһԪ��(HA)��Һ![]() ��= 1��10-8����ͬ���ʵ���Ũ�ȵ�ijһԪ��(BOH)��Һ��
��= 1��10-8����ͬ���ʵ���Ũ�ȵ�ijһԪ��(BOH)��Һ��![]() = 1��1012������������ȷ����( )
= 1��1012������������ȷ����( )
A��PH=a��HA��Һ��ϡ��10������pH=a+1
B���������HA��BOHǡ����ȫ��Ӧ����Һ��pH=7
C��HA��pH=3��BOH��pH=13
D����ͬ�����ͬpH��HA������ֱ�������Zn��Ӧ���������������ʵ�����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ2SO2+O2![]() 2SO3������2 mol SO2��1 mol 18O2��һ�������£����㹻����ʱ�䷴Ӧ������������ܳ��ֵ���
2SO3������2 mol SO2��1 mol 18O2��һ�������£����㹻����ʱ�䷴Ӧ������������ܳ��ֵ���
A. ����2 mol �������� B. 18O��ȫ����������������
C. 18O������������������������ D. 18O������������������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ʵ���Һ������һ�������������ܷ������ӷ�Ӧ�����������ǣ� ��
A.Ba��OH��2
B.Na2CO3
C.H2SO4
D.NaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ʣ�ά����A��ά����C����Ԫ�ء���Ԫ�ء����ۡ���֬����ѡ����ȷ��������Ӧ�Ŀո��
������ȱ��ij��ά���ػ�����Ѫ��������ά������__________��
������ȱ��ij����Ԫ�ػᷢ��ƶѪ��������Ԫ����__________��
�ۼ���Ϊ�����ṩ�����������ṩ����֬�����������__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʽ��NaHB��ˮ��Һ�У�HB-�ĵ���̶�С��HB-��ˮ��̶ȣ�����˵����ȷ����
A��HB-ˮ�ⷽ��ʽ��HB-+H2O![]() H3O++ B2-
H3O++ B2-
B����Һ������Ũ�ȴ�СΪ��c(Na+) > c(HB-)> c(B2-) > c(OH-) > c(H+)
C��NaHB�Ĵ��ڴٽ���ˮ�ĵ���
D����ͬ���ʵ���Ũ����Һ��pHֵ��NaHB > Na2B
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й������ʵ���;��˵������ȷ���ǣ� ��
A. SO2������Ư��ֽ�� B. ����������̼�����ƿ���������θ�����
C. �ֹ����ڴ���Ũ���� D. �����������������Ʊ���ɫ���Ϻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������8��Ԫ�ص����ʡ��������±����У��������ڵڶ���������ڡ�
| �� | �� | �� | �� | �� | �� | �� | �� |
ԭ�Ӱ뾶(10��10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
�����ͻ��ϼ� | ��2 | ��1 | ��5 | ��7 | ��1 | ��5 | ��3 | |
��2 | ��3 | ��1 | ��3 |
�ش��������⣺
��1���۵�Ԫ�ط�����____________�����Ԫ��������____________������Ԫ�����ڱ��е�λ���ǣ����ڡ��壩______________��
��2��������������ˮ�����У�������ǿ�Ļ�����ķ���ʽ��_______________��������____________��������ǿ�Ļ����������ʽ��:_______________________________�� ��������ָ���ӻ�����ۻ����_______________________��
��3���ȽϢܺ͢ߵ��⻯����ȶ���____________________
��4��д���ߵ�����������Ӧˮ����������⻯�ﷴӦ�Ļ�ѧ����ʽ__________________��
��5��д��������������Ӧˮ������ݵ��⻯��ˮ��Һ��Ӧ�����ӷ���ʽ ______________ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com