
【题目】常温下,0.1molL-1某一元酸(HA)溶液![]() 中= 1×10-8,相同物质的量浓度的某一元碱(BOH)溶液中
中= 1×10-8,相同物质的量浓度的某一元碱(BOH)溶液中![]() = 1×1012,下列叙述正确的是( )
= 1×1012,下列叙述正确的是( )
A.PH=a的HA溶液,稀释10倍,其pH=a+1
B.等体积的HA和BOH恰好完全反应,溶液的pH=7
C.HA的pH=3;BOH的pH=13
D.相同体积相同pH的HA和盐酸分别与足量Zn反应,生成氢气的物质的量相同
【答案】C
【解析】
试题分析:A.根据A可知.0.1molL-1某一元酸(HA)溶液的pH=3,说明HA为弱酸,稀释后电离程度增大,溶液中氢离子浓度增大,则溶液的pH小于a+1,故A错误;B.0.1molL-1的BOH溶液的pH=13,说明BOH为强电解质,两溶液等体积混合后生成强碱弱酸盐,溶液显示碱性,故B错误;C.常温下,溶液中![]() =1×10-8、Kw=c(H+)c(OH-)=1×10-14,联立解得c(H+)=10-3mol/L,该溶液的pH=3;联立
=1×10-8、Kw=c(H+)c(OH-)=1×10-14,联立解得c(H+)=10-3mol/L,该溶液的pH=3;联立![]() =1×1012、Kw=c(H+)c(OH-)=1×10-14解得:c(OH-)=10-1mol/L,该溶液的pH=13,故C正确;D.HA为弱酸,在溶液中只能部分电离出氢离子,pH相等的HA和盐酸中,HA的物质的量浓度大于盐酸,则相同体积相同pH的HA和盐酸分别与足量Zn反应,HA产生的氢气多,故D错误;故选C。
=1×1012、Kw=c(H+)c(OH-)=1×10-14解得:c(OH-)=10-1mol/L,该溶液的pH=13,故C正确;D.HA为弱酸,在溶液中只能部分电离出氢离子,pH相等的HA和盐酸中,HA的物质的量浓度大于盐酸,则相同体积相同pH的HA和盐酸分别与足量Zn反应,HA产生的氢气多,故D错误;故选C。


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族;其中只有两种为金属;X原子的最外层子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9.单质Y和W都可与浓的NaOH溶液反应.请回答下列问题:
(1)Y、Z、W的原子半径由小到大的顺序 .
(2)ZW2的电子式是 .
(3)实验室制备Y的最高价氧化物的水化物的离子方程式是
(4)X与Y化学性质相似,则X与浓的NaOH溶液反应的化学方程式是
(5)0.1mol的单质W与50mL 1.5mol/L的FeBr2溶液反应,则被氧化的Fe2+和Br﹣的物质的量之比是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常用药品羟苯水杨胺的合成路线如下。

已知:① ;
;
② ;
;
③当苯环上连有羧基,在苯环上引进的新取代基易进入羧基的间位。
回答下列问题:
(1)羟苯水杨胺的分子式为______,F含有的官能团名称是________。
(2)A的名称为___________。
(3)A→B所需试剂为______;D→E的反应类型属于_________。
(4)B→C反应的化学方程式为_____________。
(5)F的同分异构体中既能与FeCl3发生显色反应,又能发生银镜反应的共有_____种,其中能发生水解反应,核磁共振氢谱显示4组峰,其峰面积之比为l:2:2:1的同分异构体的结构简式是__________。
(6)写出以甲苯为原料(其他无机试剂任选)制备高聚物![]() 的合成路线______。
的合成路线______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中a、b分别是原电池的两极,接通电路后发现a极板质量增加,b极板溶解,符合这一情况的是( )
a极板 | b极板 | a电极 | Z溶液 | |
A | 锌 | 石墨 | 负极 | CuSO4 |
B | 石墨 | 石墨 | 负极 | NaOH |
C | 银 | 铁 | 正极 | AgNO3 |
D | 铜 | 石墨 | 正极 | CuCl2 |

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)NH4NO3的水溶液呈 ____________(填“酸”、“中”、“碱”)性,常温时的pH_________7(填“>”、“=”、“<”),原因是(用离子方程式表示)_______________________;
(2)某温度下纯水中的C(H+ )= 2×10-7mol/L,则此时溶液中的C(OH-)=_________;若温度不变,滴入稀盐酸,使C(H+ )= 5×10-4mol/L,则溶液中C(OH-)=________,此时溶液中由水电离产生的C (H+)=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.高纯度氢氧化镁广泛应用于医药、电力等领域。镁硅酸盐矿石可用于生产氢氧化镁,简要工艺流程如图所示:
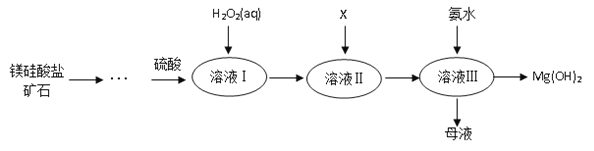
已知:
①溶液Ⅰ中除含Mg2+、SO42外,还含有少量Fe3+、Al3+、Fe2+等离子;
②常温下,几种金属离子开始沉淀和沉淀完全时的pH如下表所示:
金属离子 | Fe3+ | Al3+ | Fe2+ | Mg2+ |
开始沉淀时的pH | 1.5 | 3.3 | 6.5 | 9.4 |
沉淀完全时的pH | 3.7 | 5.2 | 9.7 | 12.4 |
请回答下列问题:
(1)镁在元素周期表中的位置_______________;
(2)向溶液Ⅱ中加入试剂X是_____________,作用是_________________________;
(3)流程中不加H2O2引起的后果是___________________________________;
(4)说出母液的一种用途___________________;
(5)加入H2O2溶液发生反应的离子方程式是___________________;
Ⅱ.海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:
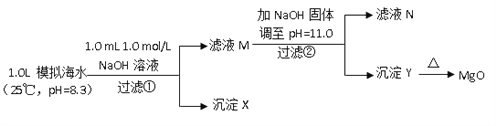
模拟海水中的离子浓度/ (mol/L) | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
注:溶液中某种离子的浓度小于1.0×10-5mol/L,可认为该离子不存在;实验过程中,假设溶液体积不变。
已知:Ksp(CaCO3)=4.96×10-9;Ksp(MgCO3)=6.82×10-6;Ksp [Ca(OH)2]=4.68×10-6;Ksp [Mg(OH)2]=5.61×10-12。请回答下列问题:
(6)沉淀物X为_____________;
(7)滤液N中Ca2+浓度为_______________;
(8)加NaOH固体调整pH=12.5是否可行______(填“是”“否”);原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
(1)反应AX3(g)+X2(g)![]() AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
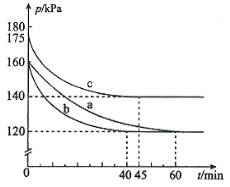
① 图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为 (填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:b 、c 。
②用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为 ;实验a平衡转化率:α(a)为 。
(2)已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成lmol AX5,放出热量123.8 kJ。该反应的热化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知五种短周期元素,A、B、C、D、E的核电荷数依次增大,其中B、E同主族,A元素的氢化物是被称为高效、较纯净的燃料;B元素是地壳中含量最多的元素;C、D、E三种原子的最外电子层电子数之和为10,且这三种元素的最高氧化物对应水化物之间两两皆能反应,均生成盐和水。
(1)推断A、B、C、D、E五种元素,写出下列元素名称:
B:________ C:________ E:_________
(2)C2E化合物名称为_____________;
(3)写出化合物AB2的电子式_____________
(4)写出D的单质与E的最高价氧化物的水化物的稀溶液反应的离子方程式为
_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中气体作氧化剂的是( )
A.SO3通入水中:SO3+H2O=H2SO4
B.Cl2通入FeCl2溶液中:Cl2+2FeCl2=2FeCl3
C.HCl通入NaOH溶液中:HCl+NaOH=NaCl+H2O
D.CO2通入NaOH溶液中:CO2+2NaOH=Na2CO3+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com