
����Ŀ��������AX3�͵���X2��һ�������·�Ӧ�����ɻ�����AX5���ش��������⣺
��1����ӦAX3(g)��X2(g)![]() AX5(g)���ݻ�Ϊ10 L���ܱ������н��С���ʼʱAX3��X2��Ϊ0.2 mol����Ӧ�ڲ�ͬ�����½��У���Ӧ��ϵ��ѹǿ��ʱ��ı仯��ͼ��ʾ��
AX5(g)���ݻ�Ϊ10 L���ܱ������н��С���ʼʱAX3��X2��Ϊ0.2 mol����Ӧ�ڲ�ͬ�����½��У���Ӧ��ϵ��ѹǿ��ʱ��ı仯��ͼ��ʾ��
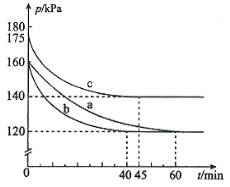
�� ͼ��3��ʵ��ӷ�Ӧ��ʼ���ﵽƽ��ʱ�ķ�Ӧ����v(AX5)�ɴ�С�Ĵ���Ϊ (��ʵ�����)����ʵ��a��ȣ���������ı��ʵ���������ж������ǣ�b ��c ��
����p0��ʾ��ʼʱ��ѹǿ��p��ʾƽ��ʱ��ѹǿ������ʾAX3��ƽ��ת���ʣ������ı���ʽΪ ��ʵ��aƽ��ת���ʣ���(a)Ϊ ��
��2����֪AX3���۵�ͷе�ֱ�Ϊ��93.6 ����76 ����AX5���۵�Ϊ167 ��������ʱAX3������X2��Ӧ����lmol AX5���ų�����123.8 kJ���÷�Ӧ���Ȼ�ѧ����ʽΪ ��
���𰸡�
��1����bca(2��)b:�����������Ӧ���ʼӿ죬��ƽ���û�иı�C:�¶����ߡ���Ӧ���ʼӿ죬��ƽ������淴Ӧ�����ƶ�(��Ӧ�������ݻ�����ʼ���ʵ���δ�ı䣬����ʼ��ѹǿ����)
����=2(1-p/p0)��50%
��2��AX3(l)+X2(g)=AX5(s)��H=��123.8kJmol��1
��������
�����������1�������ݵ�abc��ƽ����ʱ�Ķ��ٿ��ԱȽϳ���Ӧ���ʵĴ�СΪ��b��c��a����ʵ��a��ȣ�bʵ�鵽��ƽ���ʱ���С����ƽ��û�з����ƶ�������Ϊʹ�ô�����cʵ�鵽��ƽ��ʱ��ѹǿ���˵��ƽ�������ƶ�������ѧ��Ӧ���ʱ���ǵ��÷�Ӧ�Ƿ��ȷ�Ӧ�������������¶������µģ�
����p0��ʾ��ʼʱ��ѹǿ��p��ʾƽ��ʱ��ѹǿ������ʾAX3��ƽ��ת���ʣ�����ѹǿ֮�Ⱦ͵������ʵ���֮���У�![]() ��n=
��n=![]() ��
��
AX3(g)+X2(g)![]() AX5(g)
AX5(g)
��ʼ (mol) 0.20 0.20 0
ƽ�� (mol) 0.20-x 0.20-x x
(0.20-x)+(0.20-x)+x=n
x=0.40-n=0.4-![]() ��
��
��=![]() ��100%=2(1-P/P0)��100%,����a=2(1-P/P0)=2(1-120/160)=50%��
��100%=2(1-P/P0)��100%,����a=2(1-P/P0)=2(1-120/160)=50%��
��2����ΪAX3���۵�ͷе�ֱ�Ϊ-93.6����76����AX5���۵�Ϊ167��������ʱ��AX3ΪҺ̬��AX5Ϊ��̬������1mol AX5���ų�����123.8kJ���÷�Ӧ���Ȼ�ѧ����Ϊ��AX3(l)+X2(g)=AX5(s)��H=-123.8kJmol-1��


 ���ɿ��õ�Ԫ������ĩר����100��ϵ�д�
���ɿ��õ�Ԫ������ĩר����100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NO��CO��ɵĻ��������ͬ��ͬѹ�¿������ܶ���ȣ�������ƽ����Է�������Ϊ29�������й�ϵ��ȷ���ǣ� ��
A. ���������CO��NO������15:14
B. ��������У�CO��NO���Ӹ�����1:2
C. ���������COռ�е��������NOռ�е����
D. ��������У�CO��NO�ܶȱ�14:15
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£������йص������Һ��˵����ȷ����
A. pH=2��H2SO4��pH=12��NaOH�������ϣ�������Һ������
B. 0.1mol/L��CH3COOH��Һ�ټ�ˮϡ������![]() ��С
��С
C. pH=5��NaHSO3��Һ��ˮ�ĵ���̶�С�ڴ�ˮ�ĵ���̶�
D. 0.1mol/L��NaHCO3��Һ�У�c(OH-)=c(H+)+2c(H2CO3)+c(HCO3-��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�0.1molL-1ijһԪ��(HA)��Һ![]() ��= 1��10-8����ͬ���ʵ���Ũ�ȵ�ijһԪ��(BOH)��Һ��
��= 1��10-8����ͬ���ʵ���Ũ�ȵ�ijһԪ��(BOH)��Һ��![]() = 1��1012������������ȷ����( )
= 1��1012������������ȷ����( )
A��PH=a��HA��Һ��ϡ��10������pH=a+1
B���������HA��BOHǡ����ȫ��Ӧ����Һ��pH=7
C��HA��pH=3��BOH��pH=13
D����ͬ�����ͬpH��HA������ֱ�������Zn��Ӧ���������������ʵ�����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л���������У���ȷ����
A. 2��4-�������� B. 2��3��3-��������
C. 2-�һ����� D. 2��3-��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ2SO2+O2![]() 2SO3������2 mol SO2��1 mol 18O2��һ�������£����㹻����ʱ�䷴Ӧ������������ܳ��ֵ���
2SO3������2 mol SO2��1 mol 18O2��һ�������£����㹻����ʱ�䷴Ӧ������������ܳ��ֵ���
A. ����2 mol �������� B. 18O��ȫ����������������
C. 18O������������������������ D. 18O������������������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ʵ���Һ������һ�������������ܷ������ӷ�Ӧ�����������ǣ� ��
A.Ba��OH��2
B.Na2CO3
C.H2SO4
D.NaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʽ��NaHB��ˮ��Һ�У�HB-�ĵ���̶�С��HB-��ˮ��̶ȣ�����˵����ȷ����
A��HB-ˮ�ⷽ��ʽ��HB-+H2O![]() H3O++ B2-
H3O++ B2-
B����Һ������Ũ�ȴ�СΪ��c(Na+) > c(HB-)> c(B2-) > c(OH-) > c(H+)
C��NaHB�Ĵ��ڴٽ���ˮ�ĵ���
D����ͬ���ʵ���Ũ����Һ��pHֵ��NaHB > Na2B
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����CO2�У�Mgȼ������MgO��C������˵����ȷ����
A. Ԫ��C�ĵ���ֻ���ڽ��ʯ��ʯī����ͬ��������
B. Mg��MgO��þԪ�����İ뾶��r(Mg2+)>r(Mg)
C. �ڸ÷�Ӧ�����£�Mg�Ļ�ԭ��ǿ��C�Ļ�ԭ��
D. �÷�Ӧ���ڷ�������ԭ��Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com