
【题目】下列有机物的命名中,正确的是
A. 2,4-二甲基丁烷 B. 2,3,3-三甲基丁烷
C. 2-乙基戊烷 D. 2,3-二甲基戊烷
科目:高中化学 来源: 题型:
【题目】I.硫酸亚锡(SnSO4)是一种重要的能溶于水的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下:
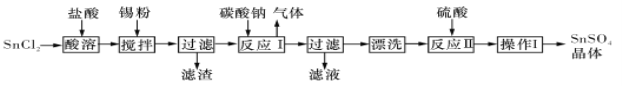
查阅资料:
A.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
B.SnC12易水解生成碱式氯化亚锡
回答下列问题:
(1)SnCl2粉末需加浓盐酸进行溶解,请结合必要的化学方程式用平衡移动原理解释原因:___________。
(2)加入Sn粉的作用有两个:①调节溶液pH;②__________。
(3)反应I得到沉淀SnO,得到该沉淀的离子反应方程式是____________。
(4)操作I是____________。
II.已知25℃时,AgI饱和溶液中c(Ag+)为1.22×10-8 mol/L,AgCl的饱和溶液中c(Ag+)为1.25×10-5 mol/L。若在10 mL含有KCl和KI各为0.01 mol/L的溶液中,加入16 mL 0.01 mol/L AgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是
c(K+)>c(NO![]() )>c(Cl-)>c(Ag+)>c(I-)
)>c(Cl-)>c(Ag+)>c(I-)
B .c(K+)>c(NO![]() )>c(Ag+)>c(Cl-)>c(I-)
)>c(Ag+)>c(Cl-)>c(I-)
C.c(K+)>c(NO![]() )>c(Ag+)=c(Cl-)+c(I-)
)>c(Ag+)=c(Cl-)+c(I-)
D.c(NO![]() )>c(K+)>c(Ag+)>c(Cl-)>c(I-)
)>c(K+)>c(Ag+)>c(Cl-)>c(I-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性溶液中,下列能大量共存的离子组是
A. S2O32-、Na+、Cl-、K+ B. Na+、Mg2+、Cl-、SO42-
C. Ba2+、Na+、SO42-、OH- D. K+、H2H5OH、MnO4-、H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)NH4NO3的水溶液呈 ____________(填“酸”、“中”、“碱”)性,常温时的pH_________7(填“>”、“=”、“<”),原因是(用离子方程式表示)_______________________;
(2)某温度下纯水中的C(H+ )= 2×10-7mol/L,则此时溶液中的C(OH-)=_________;若温度不变,滴入稀盐酸,使C(H+ )= 5×10-4mol/L,则溶液中C(OH-)=________,此时溶液中由水电离产生的C (H+)=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在元素周期表第三周期中,置换酸中氢能力最强的元素的元素符号为_____,最高价氧化物对应水化物的酸性最强的化合物的化学式是__________,碱性最强的化合物的化学式是__________,显两性的氢氧化物的化学式是__________,该两性氢氧化物与盐酸、氢氧化钠溶液分别反应的离子方程式为__________________、_________________,原子半径最大的金属元素的名称是________,离子半径最小的离子结构示意图是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
(1)反应AX3(g)+X2(g)![]() AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
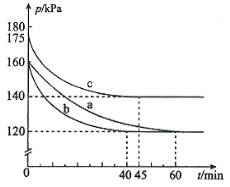
① 图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为 (填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:b 、c 。
②用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为 ;实验a平衡转化率:α(a)为 。
(2)已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成lmol AX5,放出热量123.8 kJ。该反应的热化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中进行反应2SO2 + O2![]() 2SO3,已知反应过程中某一时刻SO2、 O2、SO3的浓度分别为2 mol·L-1 、1mol·L-1 、2mol·L-1。当反应达到平衡时,容器内各物质的浓度可能为
2SO3,已知反应过程中某一时刻SO2、 O2、SO3的浓度分别为2 mol·L-1 、1mol·L-1 、2mol·L-1。当反应达到平衡时,容器内各物质的浓度可能为
A. SO2为4 mol·L-1、 O2为2 mol·L-1 B. SO3为4 mol·L-1
C. SO2为2.5 mol·L-1 D. SO2 、SO3为1.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】宋代著名法医学家宋慈的《洗冤集录》中有一“银针验毒”的记载,“银针验毒”的原理是4Ag+2H2S+O2 =2Ag2S+2H2O。该反应中H2S是
A. 氧化剂
B. 还原剂
C. 既是氧化剂又是还原剂
D. 既不是氧化剂又不是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:
CO(g)+H2S(g)![]() COS(g)+H2(g) K=0.1
COS(g)+H2(g) K=0.1
反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是
A.升高温度,H2S浓度增加,表明该反应是吸热反应
B.通入CO后,正反应速率逐渐增大
C.反应前H2S物质的量为7mol
D.CO的平衡转化率为80%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com