
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:
CO(g)+H2S(g)![]() COS(g)+H2(g) K=0.1
COS(g)+H2(g) K=0.1
反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是
A.升高温度,H2S浓度增加,表明该反应是吸热反应
B.通入CO后,正反应速率逐渐增大
C.反应前H2S物质的量为7mol
D.CO的平衡转化率为80%
【答案】C
【解析】
试题分析:A.升高温度,H2S浓度增加,说明平衡逆向移动,升高温度,平衡向吸热反应方向移动,则该反应是放热反应,故A错误;B.通入CO后,正反应速率瞬间增大,又逐渐减小,故B错误;C.反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,设反应前H2S物质的量为n,则:
CO(g)+H2S(g)COS(g)+H2(g)
起始(mol):10 n 0 0
变化(mol):2 2 2 2
平衡(mol):8 n-2 2 2
反应恰好气体分子数目不变,可以利用物质的量代替浓度计算平衡常数,则K=![]() =
=![]() =0.1,解得n=7,故C正确;D.根据上述数据,可知CO的平衡转化率为2mol/10mol×100%=20%,故D错误;故选C。
=0.1,解得n=7,故C正确;D.根据上述数据,可知CO的平衡转化率为2mol/10mol×100%=20%,故D错误;故选C。


科目:高中化学 来源: 题型:
【题目】对下图中两极加以必要的联接并填空:
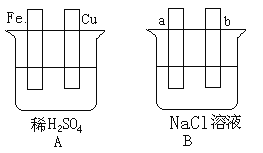
(1)在A图中,请加以必要联接,使铜片上冒H2气泡。________
Fe片的电极反应式:________________,溶液中SO42-向____(填“铁”或“铜”)片迁移。
(2)在B图中,请加以必要联接,使b极析出Cl2。总反应方程式:___________________。
(3)若将A、B串联(a接Cu,b接Fe),则a极析出的物质是____________。若导线中有0.2mol的电子通过, 则Fe片质量减少________, 同时a电极产生的气体在标准状况下的体积为__________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中,一定需加还原剂才能实现的是( )
A. CO2 → CO32- B. FeCl3 → FeCl2 C. C → CO2 D. HCl → MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在CO2中,Mg燃烧生成MgO和C。下列说法正确的是
A. 元素C的单质只存在金刚石和石墨两种同素异形体
B. Mg、MgO中镁元素微粒的半径:r(Mg2+)>r(Mg)
C. 在该反应条件下,Mg的还原性强于C的还原性
D. 该反应属于非氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物。回答下列问题:
(l)汽车发动机工作时会引起反应:N2(g)+O2(g)![]() 2NO(g),是导致汽车尾气中含有NO的原因之一。2000K时,向容积为2L的密闭容器中充入2molN2与2molO2,发生上述反应,经过5min达到平衡,此时容器内NO的体积分数为0.75% .则该反应在5min内的平均反应速率v(O2)=_______mol/(Lmin),N2的平衡转化率为_______,2000K时该反应的平衡常数K=_____。
2NO(g),是导致汽车尾气中含有NO的原因之一。2000K时,向容积为2L的密闭容器中充入2molN2与2molO2,发生上述反应,经过5min达到平衡,此时容器内NO的体积分数为0.75% .则该反应在5min内的平均反应速率v(O2)=_______mol/(Lmin),N2的平衡转化率为_______,2000K时该反应的平衡常数K=_____。
(2)一定量NO发生分解的过程中,NO的转化率随时间变化的关系如右图所示。

① 反应2NO(g)![]() N2(g)+O2(g)为______反应(填“吸热”或“放热”) ;
N2(g)+O2(g)为______反应(填“吸热”或“放热”) ;
②一定温度下,能够说明反应2NO(g)![]() N2(g)+O2(g)已达到平衡的是_____(填序号);
N2(g)+O2(g)已达到平衡的是_____(填序号);
a.容器内的压强不发生变化
b.混合气体的密度不发生变化
c. 2NO、N2、O2的浓度保持不变
d.单位时间内分解4molNO,同时生成2molN2
③ 在四个容积和温度均完全相同的密闭容器中分别加入下列物质,相应物质的量(mol)如下表所示。相同条件下达到平衡后,N2的体积分数最大的是_______(填容器代号);
容器代号 | NO | N2 | O2 |
A | 2 | 0 | 0 |
B | 0 | l | l |
C | 0.4 | 0.6 | 0.8 |
D | l | 0.5 | 0.4 |
(3)当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx。可用CH4催化还原NOx以消除氮氧化物污染。
已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ·mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ·mol-1
①写出CH4与NO反应生成N2、CO2、H2O(g)的热化学方程式:___________;
②使用催化剂可以将汽车尾气的主要有害成分一氧化碳(CO)和氮氧化物(NOx)转化为无毒气体,该反应的化学方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘是一种重要的药用元素,缺乏碘能导致甲状腺肿大等.为预防碘缺乏病,目前我国的食盐都是“加碘食盐”.“加碘食盐”中加的是含碘元素的物质是碘酸钾(KIO3),KIO3属于( )
A.酸
B.碱
C.盐
D.氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质既可以与盐酸反应,又可以与NaOH溶液反应放出H2,且E的阳离子与A的阴离子核外电子层结构完全相同。

回答下列问题:
(1)A与E形成的化合物的化学式是 __________________。
(2)B的最高价氧化物化学式为_____________,C的元素名称为 __________,D的单质与水反应的方程式为___________________。
(3)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量,观察到的现象是________________________,有关反应的离子方程式为________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com