
【题目】有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质既可以与盐酸反应,又可以与NaOH溶液反应放出H2,且E的阳离子与A的阴离子核外电子层结构完全相同。

回答下列问题:
(1)A与E形成的化合物的化学式是 __________________。
(2)B的最高价氧化物化学式为_____________,C的元素名称为 __________,D的单质与水反应的方程式为___________________。
(3)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量,观察到的现象是________________________,有关反应的离子方程式为________________________。
【答案】 Al2O3 P2O5 硫 Cl2+H2O=HCl+HClO 先有白色胶状沉淀产生并逐渐增多,随NaOH加入又逐渐溶解最终澄清 Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=AlO2-+2H2O
【解析】根据A、B、C、D四种短周期元素在图中位置可知,A为第二周期元素,B、C、D为第三周期元素,设C的核外电子数为X,则A、B、D的最外层电子数为分别为X-8,X-1,X+1,所以:X+X-8+X-1+X+1=56,解得X=16,则B为磷,C为硫,D为氯,A为氧;根据E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2,可知E为+3价金属,又E的阳离子与A的阴离子核外电子层结构相同,则E为铝.
(1)根据由金属元素和非金属元素形成的化学键一般为离子键;
(2)根据由非金属元素和非金属元素形成的化学键一般为共价键;
(3)根据氢氧化铝为两性氧化物既可与酸反应,也可与碱反应;
解析:根据以上分析,(1)因A为氧,E为铝,A与E形成的化合物的化学式是Al2O3;
(2)因B为磷元素,所以B的最高价氧化物化学式为P2O5;C为硫元素;D为氯,其单质氯气与水反应生成盐酸和次氯酸:Cl2+H2O![]() H++Cl-+HClO;
H++Cl-+HClO;
(3)氢氧化铝为难溶于水的两性氢氧化物能与碱反应生成盐和水,所以向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量,观察到的现象是先有白色胶状氢氧化铝沉淀产生并逐渐增多,随NaOH加入氢氧化铝又逐渐溶解,最终澄清,离子方程式为:Al3++3OH-=Al(OH)3↓ (7). Al(OH)3+OH-=AlO2-+2H2O。
点睛;氢氧化铝为难溶于水的两性氢氧化物能与碱反应生成盐和水,又能与酸反应生成盐和水。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:
CO(g)+H2S(g)![]() COS(g)+H2(g) K=0.1
COS(g)+H2(g) K=0.1
反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是
A.升高温度,H2S浓度增加,表明该反应是吸热反应
B.通入CO后,正反应速率逐渐增大
C.反应前H2S物质的量为7mol
D.CO的平衡转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,
总反应为:2CH3CHO+H2O![]() CH3CH2OH+CH3COOH
CH3CH2OH+CH3COOH
实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示。

(1)若以甲烷燃料电池为直流电源,则燃料电池中b极应通入 (填化学式)气体。
(2)电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体。电极反应如下:
阳极:① 4OH--4e-=O2↑+2H2O② 。
阴极:① 。②CH3CHO+2e-+2H2O=CH3CH2OH+2OH-
(3)电解过程中,阴极区Na2SO4的物质的量 (填“增大”、“减小”或“不变”)。
(4)电解过程中,某时刻测定了阳极区溶液中各组分的物质的量,其中Na2SO4与CH3COOH的物质的量相同。下列关于阳极区溶液中各微粒浓度关系的说法正确的是 (填字母序号)。
a.c(Na+)不一定是c(SO42-)的2倍
b.c(Na+)=2c(CH3COOH)+2c(CH3COO-)
c.c(Na+)+c(H+)=c(SO42-)+c(CH3COO-)+c(OH-)
d.c(Na+)>c(CH3COOH)>c(CH3COO-)>c(OH-)
(5)高纯度氧化铝是用于制备隔膜的材料,某研究小组用以下流程制取高纯度氧化铝:

①“除杂”操作是加入过氧化氢后,用氨水调节溶液的pH约为8.0,以除去硫酸铵溶液中的少量Fe2+。请写出在除去Fe2+离子的过程中,发生的主要反应的离子方程式 。
②配制硫酸铝溶液时,需用硫酸酸化,酸化的目的是 。
③“结晶”这步操作中,母液经蒸发浓缩至溶液表面刚出现薄层晶体即停止加热,然后冷却结晶,得到铵明矾晶体(含结晶水)。母液不能蒸干的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种低碳能源,在全球能源危机和环境污染的背景下具有良好的发展前景。在催化剂作用下可用H2和CO合成甲醇,反应的化学方程式为 2H2(g)+CO(g)![]() CH3OH(g),三种物质的物质的量浓度随时间变化的关系如图所示。
CH3OH(g),三种物质的物质的量浓度随时间变化的关系如图所示。

回答下列问题:
(1)代表H2浓度变化的曲线为_______(填“a”、“b”或“c”)。
(2)提出一条可以加快反应速率的措施:______________________________。
(3)04 min内,CH3OH的平均反应速率为_________________。
(4)我国某高校化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如图所示。

①该电池工作时,c口通入的物质为_____________,该电极为____(填“正极”或“负极”)。
②该电池工作一段时间后,,当6.4 g甲醇完全反应生成CO2时,消耗的氧气的体积为_____L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,a、b、c、d、e为元素周期表中前4周期的一部分元素,下列有关叙述正确的是( )
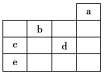
A. 元素b位于第ⅥA族,有+6、-2价两种常见化合价
B. 五种元素中,元素e的性质最稳定
C. 元素c和d的最高价氧化物对应的水化物的酸性:c>d
D. 元素c和e的气态氢化物的稳定性:c>e
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍电池广泛应用于混合动力汽车系统,电极材料由NiO2、Fe和碳粉涂在铝箔上制成。放电过程中产生Ni(OH)2和Fe(OH)2,Fe(OH)2最终氧化、脱水生成氧化铁。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行回收研究。
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②某温度下一些金属氢氧化物的Ksp及开始沉淀和完全沉淀时的理论pH如表所示:
M(OH)n | Ksp | pH | |
开始沉淀 | 沉淀完全 | ||
Al(OH)3 | 2.0×10-32 | 3.8 | —— |
Fe(OH)3 | 4.0×10-38 | 1.9 | 3.2 |
Fe(OH)2 | 8.0×10-16 | 6.95 | 9.95 |
Ni(OH)2 | 6.5×10-18 | 5.9 | 8.9 |
回答下列问题:
(1)该电池的负极材料是___________________,正极反应式为_________________,
(2)若电池输出电压为3V,给2W灯泡供电,当电池消耗0.02gFe,理论上电池工作__________min(小数点后保留2位)。(已知F=96500C/mol)
(3)将电池电极材料用盐酸溶解后加入适量双氧水,其目的是_____________。过滤,在滤液中慢慢加入NiO固体,则开始析出沉淀时的离子方程式是_______________和___________________。若将两种杂质阳离子都沉淀析出,pH应控制在___________(离子浓度小于或等于1×10-5mol/L为完全沉淀,lg2=0.3、lg3=0.5);设计将析出的沉淀混合物中的两种物质分离开来的实验方案_____________。
(4)将加入NiO过滤后的溶液加入Na2C2O4,得到NiC2O4·2H2O和滤液A,A的主要成分是_____________;电解滤液A,在阴极产生气体B______(填分子式);在阳极产生气体C______(填分子式)。将NiC2O4·2H2O加入到电解后的溶液,再通入电解时某电解产生的气体,即可得到回收产品Ni(OH)3,所通入气体为______(填“B”、“C”)极气体,判断依据是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有CaCO3固体的溶液中滴加少许浓盐酸(忽略体积变化),下列数值变小的是( )
A.c(H+) B. c(Ca2+) C. c(CO32-) D. Ksp(CaCO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏钒酸铵(NH4VO3)主要用作催化剂、催干剂、媒染剂等。用沉淀法除去工业级偏钒酸铵中的杂质硅、磷的流程如下:
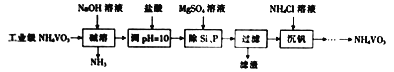
(1)碱溶时,下列措施有利于NH3逸出的是_____(填字母)。
A.升高温度 B.增大压吸 C.增大NaOH溶液的浓度
(2)①滤渣的主要成分为Mg3(PO4)2、MgSiO3,已知Ksp(MgSiO3)=2.4×l0-5.若滤液中c(SiO32-)=0.08mol/L,则c(Mg2+)=__________。
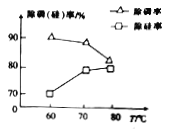
②由图可知,加入一定量的MgSO4溶液作沉淀剂时,随着温度的升高,除磷率下降,其原因是温度升高,Mg3(PO4)2溶解度增大和_______;但随着温度的升高,除硅率升高,其原因是______(用离子方程式表示)。
(3)沉钒时,反应温度需控制在50℃,在实验室可采取的加热方式为_______。
(4)探究NH4Cl的浓度对沉钒率的影响,设计实验步骤(常见试剂任选):取两份10mL一定浓度的滤液A和B,分别加入lmL和10mL的1mol/LNH4Cl溶液,再向A中加入_______mL蒸馏水,控制两份溶液温度均为50℃、pH均为8,由专用仪器洲定沉钒率。加入蒸馏水的目的是______。
(5)偏钒酸铵本身在水中的溶解度不大,但在草酸(H2C2O4)溶液中因发生氧化还原反应而溶解,同时生成络合物(NH4)2[(VO)2(C2O4)3],该反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于废弃塑料制品的处理方法中,最为恰当的是
A. 将废弃物焚烧 B. 将废弃物应用化学方法加工成防水涂料或汽油
C. 将废弃物倾倒在海洋中 D. 将废弃物切成碎片,混在垃圾中填埋于土壤中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com