
| A. | 将钢闸门与直流电源的正极相连,可降低钢闸门腐蚀速率 | |
| B. | 镀锌铁制品镀层受损后,铁制品仍不易生锈 | |
| C. | 粗铜精炼时,电镀液中的c(Cu2+)保持不变 | |
| D. | 纯银在空气中久置变黑发生的是电化学腐蚀 |
分析 A.应将钢闸门与直流电源的负极相连;
B.锌比铁活泼,形成原电池反应时为负极;
C.粗铜精炼时,阳极不仅仅是铜放电,还有锌、铁等;
D.因在空气中发生化学腐蚀,生成硫化银.
解答 解:A.将钢闸门与直流电源的负极相连,为外加电源的阴极保护法,可降低钢闸门腐蚀速率,故A错误;
B.锌比铁活泼,形成原电池反应时为负极,锌被氧化,铁被保护,故B正确;
C.粗铜精炼时,阳极不仅仅是铜放电,还有锌、铁等,而阴极只有铜离子放电,则电镀液中的c(Cu2+)减小,故C错误;
D.纯银在空气中久置变黑发生化学腐蚀,生成硫化银,故D错误.
故选B.
点评 本题综合考查原电池、电解池知识,为高频考点,侧重于化学与生活、生产的考查,注意把握原电池、电解池的工作原理,难度不大.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:解答题
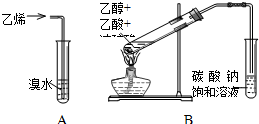 请回答下列问题:
请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
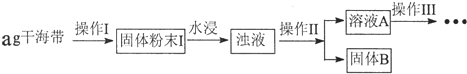
| 序号 | 实验操作 | 实验现象 | 结论 |
| ① | 取少量稀释后的溶液A加入淀粉后再用硫酸酸化,分装于试管Ⅰ、Ⅱ | 无现象 | |
| ② | 往试管I中加入FeCl2溶液,后加入2滴KSCN溶液并振荡; | 无现象 | 证明不是以IO3-形式存在 |
| ③ | 往试管II中加入3%H2O2溶液并振荡 | 溶液变蓝 | 证明以I-形式存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的相对原子质量 | B. | 原子的核内中子数 | ||
| C. | 原子的次外层电子数 | D. | 原子的电子层数和最外层电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同样多 | B. | HCl最多 | C. | HCl、HNO3一样多 | D. | CH3COOH最少 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:b>a>c>d | B. | 原子半径:A>B>C>D | ||
| C. | 金属性:B>A,非金属性:D>C | D. | 离子半径:D>C>B>A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | 将磁性氧化铁溶于HI溶液:Fe3O4+8H+═Fe2++2Fe3++4H2O |
| B | 明矾[KAl(SO4)2]溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀: 2Ba2++3OH-+Al3++2SO42-═2BaSO4↓+Al(OH)3↓ |
| C | 用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O═2HCO3-+SO32- |
| D | NH4HCO3溶液中滴入过量的NaOH溶液:HCO3-+OH-═CO32-+H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
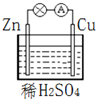
| A. | 该装置能将电能转化为化学能 | B. | 电子由锌片通过导线流向铜片 | ||
| C. | 负极反应为 Zn-2e-═Zn2+ | D. | Cu为正极材料,正极发生还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com