
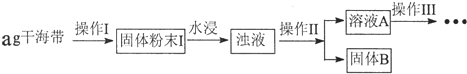
| 序号 | 实验操作 | 实验现象 | 结论 |
| ① | 取少量稀释后的溶液A加入淀粉后再用硫酸酸化,分装于试管Ⅰ、Ⅱ | 无现象 | |
| ② | 往试管I中加入FeCl2溶液,后加入2滴KSCN溶液并振荡; | 无现象 | 证明不是以IO3-形式存在 |
| ③ | 往试管II中加入3%H2O2溶液并振荡 | 溶液变蓝 | 证明以I-形式存在 |
分析 (1)依据流程图分析,操作Ⅰ固体灼烧在坩埚中;操作Ⅱ是分离固体和液体的实验操作过滤;
(2)加热使含碘物质更多地溶解于水溶液中;
(3)②利用亚铁离子具有还原性,碘酸根离子在酸性溶液中具有氧化性,亚铁离子与硫氰酸钾溶液反应生成血红色溶液;
③利用试剂过氧化氢具有氧化性可以氧化碘离子为碘单质,遇到淀粉变蓝;
(4)依据A溶液中碘离子被高锰酸钾溶液氧化为碘单质,碘单质被硫代硫酸钠溶液还原为碘离子,中和滴定过程中,到蓝色恰好褪去不再变化证明反应到终点;依据离子方程式计算得到碘 元素含量.
解答 解:(1)流程图分析,操作Ⅰ固体灼烧在坩埚中;操作Ⅱ是分离固体和液体的实验操作过滤,
故答案为:坩埚;过滤;
(2)水浸要将悬浊液煮沸2-3min是为了增大含碘物质的溶解度,使更多的含碘物质溶解,
故答案为:加快含碘物质在水中的溶解,以使灰烬中的含碘物质尽可能多的进入溶液;
(3)②利用亚铁离子具有还原性,碘酸根离子在酸性溶液中具有氧化性,检验是否含有铁离子,往试管I中加入氯化亚铁溶液,后加入2滴KSCN溶液并振荡,无血红色出现证明不是以IO3-形式存在;
故答案为:无现象;
③往试管II中加入3%过氧化氢具有氧化性可以氧化碘离子为碘单质,遇到淀粉变蓝,
故答案为:3% H2O2溶液并振荡;溶液变蓝;
(4)A溶液中碘离子被高锰酸钾溶液氧化为碘单质,碘单质被硫代硫酸钠溶液还原为碘离子,中和滴定过程中,到蓝色恰好褪去不再变化证明反应到终点;设碘离子物质的量为x,
2I-~I2~2Na2S2O3
2 2
x 0.01mol/L×V×10-3L
x=V×10-5mol
200ml溶液中含碘元素物质的量为=V×10-4mol
海带中碘元素的百分含量=$\frac{V×1{0}^{-4}×127g/mol}{ag}$×100%=$\frac{1.27v}{a}%$,
故答案为:溶液蓝色刚好褪去,30s内不恢复蓝色;$\frac{1.27v}{a}%$.
点评 本题考查了物质制备的流程分析判断,实验方案的设计原则和步骤,滴定实验的计算应用,反应现象和物质性质是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
 .
.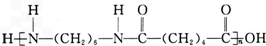 +(2n-1)H2O.
+(2n-1)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、Fe3+、Cl-、NO3- | B. | Na+、Ca2+、HCO3-、NO3- | ||
| C. | Al3+、NH4+、SO42-、Na+ | D. | Na+、K+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内生成n mol A2的同时消耗n mol A2 | |
| B. | 容器内的各组分的浓度不随时间变化而变化 | |
| C. | 单位时间内生成2n mol AB的同时生成n mol B2 | |
| D. | A2、B2和AB的分子数之比为1:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、纤维素水解的最终产物均为葡萄糖 | |
| B. | 糖类、油脂、蛋白质都是高分子化合物,都能发生水解反应 | |
| C. | 葡萄糖既可以与银氨溶液反应,又可以与新制氢氧化铜悬浊液反应 | |
| D. | 天然油脂没有固定的熔点和沸点,所以天然油脂是混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将钢闸门与直流电源的正极相连,可降低钢闸门腐蚀速率 | |
| B. | 镀锌铁制品镀层受损后,铁制品仍不易生锈 | |
| C. | 粗铜精炼时,电镀液中的c(Cu2+)保持不变 | |
| D. | 纯银在空气中久置变黑发生的是电化学腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
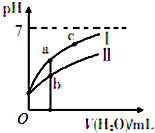 已知下表为25℃时某些弱酸的电离平衡常数;如图表示常温时,稀释CH3COOH、HC1O两种酸的稀溶液时,溶液pH随加水量的变化.
已知下表为25℃时某些弱酸的电离平衡常数;如图表示常温时,稀释CH3COOH、HC1O两种酸的稀溶液时,溶液pH随加水量的变化.| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | K$_{{a}_{1}}$a1=4.4×10-7K$_{{a}_{2}}$a2=4.7×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com