
分析 (1)根据在碱性溶液中:S2O32-+4I2+10OH-=2SO42-+8I-+5H2O,3I2 +6OH-=IO3-+5I-+3H2O 在酸性溶液中:S2O32-+2H+=SO2↑+S+H2O,4I-+O2+4H+=2I2+2H2O确定反应的条件;
(2)依据滴定实验基本操作和实验步骤分析可知,需要的玻璃仪器为:酸式、碱式滴定管、锥形瓶、胶头滴管;
解答 解:(1)碘(I2)与S2O32-的反应必须在在中性、弱酸性溶液中进行反应,若在碱性溶液中:S2O32-+4I2+10OH-=2SO42-+8I-+5H2O,3I2 +6OH-=IO3-+5I-+3H2O;若在酸性溶液中:S2O32-+2H+=SO2↑+S+H2O,4I-+O2 (空气中)+4H+=2I2+2H2O;
故答案为:若在碱性溶液中:S2O32-+4I2+10OH-=2SO42-+8I-+5H2O,3I2 +6OH-=IO3-+5I-+3H2O;
若在酸性溶液中:S2O32-+2H+=SO2↑+S+H2O,4I-+O2+4H+=2I2+2H2O;
(2)依据滴定实验基本操作和实验步骤分析可知,需要的玻璃仪器为:酸式、碱式滴定管、锥形瓶、胶头滴管;
故答案为:酸式、碱式滴定管、锥形瓶、胶头滴管;
点评 本题考查了氧化还原反应滴定,掌握实验的原理和滴定过程是解题的关键,难度中等.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | X是非金属元素 | |
| B. | X形成含氧酸钾盐化学式可能为KXO2、KXO3或KXO4 | |
| C. | 由X形成的含氧酸均为强酸 | |
| D. | X不可能为第一周期元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
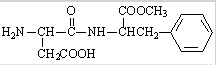 关于该有机物的说法不正确的是( )
关于该有机物的说法不正确的是( )| A. | 在适当催化剂作用下可形成高分子化合物 | |
| B. | 该有机物完全燃烧时生成CO2、H2O、NH3 | |
| C. | 1mol该有机物在盐酸中发生水解反应时最多消耗2molH+ | |
| D. | 1mol该有机物最多能与3molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
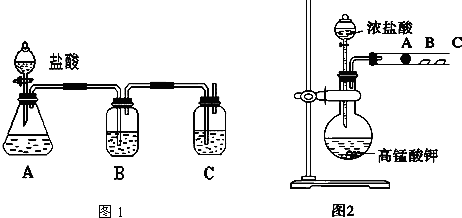
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 42g环丙烷和丙烯的混合气体中氢原了数目一定为6NA | |
| B. | 1L 0.1mol/L的NH4NO3溶液中原子数少于0.2NA | |
| C. | 在常温常压下,22.4LHF所含分子数为NA | |
| D. | 5.6gFe与足量的水蒸气完全反应,转移电子的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定温度下,将氨水稀释,NH3?H2O 的电离度增大,H2O 的电离度也增大 | |
| B. | 水中加酸加碱都会阻碍水的电离,所以 c(H+)?c(OH-)<10-14 | |
| C. | 水中加酸,阻碍水的电离,所以 c(H+)=c(OH-)<10-7 mol•L-1 | |
| D. | 醋酸溶液加水稀释,溶液中所有微粒的浓度都会降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
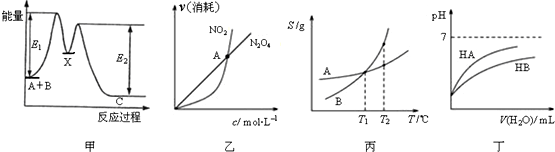
| A. | 由甲可知:加入催化剂可改变反应A+B→C的焓变 | |
| B. | 由乙可知:对于恒温恒容条件下的反应2NO2(g)?N2O4(g),A点为平衡状态 | |
| C. | 由丙可知:将A、B饱和溶液分别由T1℃升温至T2℃时,溶质的质量分数B>A | |
| D. | 由丁可知:相同温度、相同浓度的HA溶液与HB溶液相比,其pH前者小于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com