
科目:高中化学 来源: 题型:阅读理解
| 浓度/mol?L-1 时间/min |
NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
查看答案和解析>>
科目:高中化学 来源:海南省琼海市嘉积中学2011-2012学年高二上学期教学质量监测(二)化学试题 题型:058
氨在工农业生产中应用广泛.在压强为30 MPa时,合成氨平衡混合气体中NH3的体积分数如下:
请回答:
(1)根据表中数据分析,该反应是________反应.(“吸热”或“放热”)
(2)在一定温度下,将2 mol N2和6 mol H2通入到体积为2 L的密闭容器中,发生反应N2+3H2![]() 2NH3,2 min达到平衡状态时,H2转化率是50%,该温度下的平衡常数K=________(用分数表示);欲使K增大,可以采取的措施是________.
2NH3,2 min达到平衡状态时,H2转化率是50%,该温度下的平衡常数K=________(用分数表示);欲使K增大,可以采取的措施是________.
(3)从化学平衡移动的角度分析,提高H2转化率可以采取的措施是________(选填序号字母)
a、及时分离出NH3
b、升高温度
c、增大压强
d、使用催化剂
(4)NH3也能分解为N2和H2,在相同条件下,测得分解后混合气体密度为分解前的2/3,则氨的分解率为________.
(5)根据下图的能量变化,求下列反应的反应热.

N2(g)+3H2(g)![]() 2NH3(l) ΔH=________.
2NH3(l) ΔH=________.
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省梅州市高三总复习质检二理综化学试卷(解析版) 题型:计算题
乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:
2CO(g) + 4H2(g)  CH3CH2OH(g) + H2O(g)
△H = —256.1 kJ·mol-1
CH3CH2OH(g) + H2O(g)
△H = —256.1 kJ·mol-1
已知:CO(g) + H2O(g)  CO2(g)+H2(g)
△H= —41.2 kJ·mol-1
CO2(g)+H2(g)
△H= —41.2 kJ·mol-1
(1)以CO2(g)与H2(g)为原料也可合成乙醇,其热化学方程式如下:
2CO2(g) +6H2(g)  CH3CH2OH(g) +3H2O(g)
△H = 。
CH3CH2OH(g) +3H2O(g)
△H = 。
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。
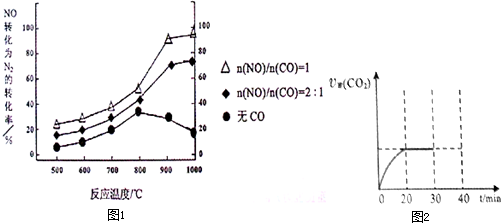
①某研究小组在实验室以Ag– ZSM– 5为催化剂,测得NO转化为N2的转化率随温度变化情况如下图。若不使用CO,温度超过800℃,发现NO的转化率降低,其可能的原因为 ;在n(NO)/n(C O)=1的条件下,应控制的最佳温度在 左右。

②用活性炭还原法处理氮氧化物。有关反应为:C (s) +2NO2(g)
 N2 (g) + CO2
(g)。某研究小组向某密闭容器中加人足量的活性炭和NO,恒温( T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2 (g) + CO2
(g)。某研究小组向某密闭容器中加人足量的活性炭和NO,恒温( T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
|
浓度/mol∙L-1 时间/min |
NO |
N2 |
CO2 |
|
0 |
1.00 |
0 |
0 |
|
20 |
0.40 |
0.30 |
0.30 |
|
30 |
0.40 |
0.30 |
0.30 |
|
40 |
0.32 |
0.34 |
0.17 |
|
50 |
0.32 |
0.34 |
0.17 |
I.根据表中数据,求反应开始至20min以v(NO)表示的反应速率为 (保留两位有效数字),T1℃时该反应的平衡常数为 (保留两位有效数字)。
II.30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 。下图表示CO2的逆反应速率[v逆(CO2)]随反应时间的变化关系图。请在图中画出在30min改变上述条件时,在40min时刻再次达到平衡的变化曲线。

查看答案和解析>>
科目:高中化学 来源:河南省模拟题 题型:推断题

查看答案和解析>>
科目:高中化学 来源:2011-2012学年湖北省部分重点中学高二上学期期中联考化学试卷 题型:填空题
(11分)氨在工农业生产中应用广泛。在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如下:
| 温度/℃ | 200 | 300 | 400 | 500 | 600 |
| 氨含量/% | 89.9 | 71.0 | 47.0 | 26.4 | 13. 8 8 |
 2NH3,2 min达到平衡状态时,H2转化率是50%,该温度下的平衡常数K=______________(用分数表示);欲使K增大,可以采取的措施是___________________。
2NH3,2 min达到平衡状态时,H2转化率是50%,该温度下的平衡常数K=______________(用分数表示);欲使K增大,可以采取的措施是___________________。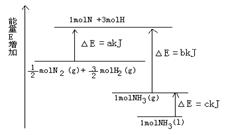
 2NH3(l) △H=___________。
2NH3(l) △H=___________。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com