
【题目】对标准状况下的四种气体的关系从小到大表示不正确的是
①6.72L甲烷 ②3.01×1023HCl分子 ③13.6g H2S ④0.2mol NH3
A.质量:④<①<③<②B.密度:①<④<③<②
C.体积:④<①<②<③D.氢原子数:②<④<③<①
【答案】C
【解析】
①6.72LCH4物质的量为![]() =0.3mol;
=0.3mol;
②3.01×1023个HCl分子的物质的量为0.5mol;
③13.6g H2S 的物质的量为![]() =0.4mol;
=0.4mol;
④0.2mol NH3;
A、各物质的质量分别为①CH4为0.3mol×16g/mol=4.8g,②HCl为0.5mol×36.5g/mol=33.25g,③H2S 13.6g,④NH3为0.2mol×17g/mol=3.4g,所以质量④<①<③<②,A项正确;
B、各物质的摩尔质量分别为①CH416g/mol②HCl为36.5g/mol ③H2S 为34g/mol④NH3为17g/mol,相同条件下,密度之比等于摩尔质量之比,所以密度①<④<③<②,B项正确;
C、相同条件下,气体的体积之比等于物质的量之比,所以体积体积④<①<③<②,C项错误;
D、各物质中H原子的物质的量分别为①CH4为0.3mol×4=1.2mol②HCl为0.5mol③H2S 0.4mol×2=0.8mol④NH3为0.2mol×3=0.6mol,所以氢原子个数②<④<③<①,D项正确;
答案选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某校课外小组为测定某碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数,甲、乙两组同学分别进行了下列相关实验。
方案Ⅰ.甲组同学用沉淀分析法,按如图所示的实验流程进行实验:
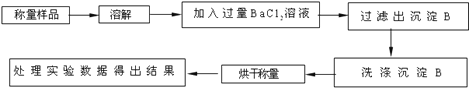
![]() 实验时,过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为 ______ ;
实验时,过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为 ______ ;
![]() 检验沉淀B已洗净操作是 ______ ;
检验沉淀B已洗净操作是 ______ ;
![]() 若实验中测得样品质量为mg,沉淀质量为ng,则碳酸钠的质量分数为 ______ 。
若实验中测得样品质量为mg,沉淀质量为ng,则碳酸钠的质量分数为 ______ 。
方案Ⅱ.乙组同学的主要实验![]() 如图
如图![]()

按如图所示装置进行实验:
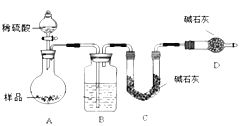
![]() 该实验中装置B盛放的物质是 ______ ,分液漏斗中 ______
该实验中装置B盛放的物质是 ______ ,分液漏斗中 ______ ![]() 填“能”或“不能”
填“能”或“不能”![]() 用盐酸代替稀硫酸进行实验;
用盐酸代替稀硫酸进行实验;
![]() 在C中装碱石灰来吸收净化后的气体。
在C中装碱石灰来吸收净化后的气体。
![]() 样品中碳酸钠的质量分数越大,则实验中吸收净化后气体的干燥管在充分吸收气体前后的质量差 ______(填“越大”、“越小”或“不变化”);
样品中碳酸钠的质量分数越大,则实验中吸收净化后气体的干燥管在充分吸收气体前后的质量差 ______(填“越大”、“越小”或“不变化”);
![]() 装置的作用是 ______ 。
装置的作用是 ______ 。
![]() 有的同学认为为了减少实验误差,在反应前后都要通入
有的同学认为为了减少实验误差,在反应前后都要通入![]() 如图
如图![]() ,反应后通入
,反应后通入![]() 的目的是 ______ 。
的目的是 ______ 。

查看答案和解析>>
科目:高中化学 来源: 题型:
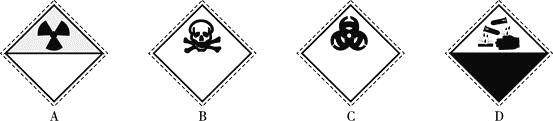
【题目】氰化钠![]() 是重要的化工原料,易溶于水,易水解生成氰化氢,剧毒物质。常用于电镀、冶金、有机合成医药、络合剂和掩蔽剂。
是重要的化工原料,易溶于水,易水解生成氰化氢,剧毒物质。常用于电镀、冶金、有机合成医药、络合剂和掩蔽剂。
![]() 装氰化钠
装氰化钠![]() 试剂瓶的标签上应印有下列警示标记中的________
试剂瓶的标签上应印有下列警示标记中的________![]() 填序号
填序号![]() 。
。
![]() 实验室用NaCN固体配制NaCN溶液时,为避免其水解,应先将其溶于______________浓溶液,再用蒸馏水稀释。
实验室用NaCN固体配制NaCN溶液时,为避免其水解,应先将其溶于______________浓溶液,再用蒸馏水稀释。
![]() 泄漏时用双氧水处理以减轻环境污染,处理后生成一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,该反应的离子方程式是__________________________________________。
泄漏时用双氧水处理以减轻环境污染,处理后生成一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,该反应的离子方程式是__________________________________________。
![]() 化学兴趣小组利用:2NH
化学兴趣小组利用:2NH![]() 反应原理制备NaCN并检测其纯度。
反应原理制备NaCN并检测其纯度。
实验一:制备NaCN装置如图所示
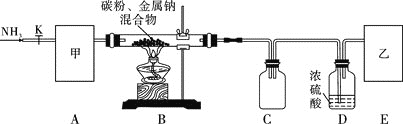
![]() 装置C的作用是____________。甲可选取下列装置中的________
装置C的作用是____________。甲可选取下列装置中的________![]() 填序号
填序号![]() 。
。

![]() 安装好实验仪器,检查装置气密性,取一定量的碳粉与金属钠混合,放入硬质玻璃管内;接下来的操作正确的是________
安装好实验仪器,检查装置气密性,取一定量的碳粉与金属钠混合,放入硬质玻璃管内;接下来的操作正确的是________![]() 填序号
填序号![]() 。
。
A.先打开活塞K,缓缓通入一段时间氨气后再加热硬质玻璃管
B.先加热硬质玻璃管,再打开活塞K,缓缓通入氨气
C.打开活塞K,一边缓缓通入氨气,同时加热硬质玻璃管
![]() 上述装置中乙处还需补充的实验仪器或装置有__________________。
上述装置中乙处还需补充的实验仪器或装置有__________________。
实验二:测定产品中氰化钠的含量
![]() 已知: Ag
已知: Ag![]() ,Ag
,Ag![]() ,AgI呈黄色,且CN
,AgI呈黄色,且CN![]() 优先与Ag
优先与Ag![]() 反应。取制备好的产品
反应。取制备好的产品![]() ,配成
,配成![]() 溶液,取
溶液,取![]() 于锥形瓶中,并滴加
于锥形瓶中,并滴加![]() 滴KI溶液作指示剂,用
滴KI溶液作指示剂,用![]() 的标准AgNO
的标准AgNO![]() 溶液滴定3次,平均消耗AgNO
溶液滴定3次,平均消耗AgNO![]() 溶液的体积为
溶液的体积为![]() 。滴定终点的现象是____________________________________________________________,产品氰化钠的纯度为________
。滴定终点的现象是____________________________________________________________,产品氰化钠的纯度为________![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素a、b、c、d的原子序数依次增大。其中A为d元素组成的单质;甲、乙、丙、丁、戊为上述四种元素组成的二元或三元化合物,常温下乙为液体。下列说法正确的是
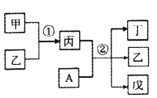
A.简单离子半径:c >b
B.反应①为吸热反应
C.②在常温下反应时,氧化剂与还原剂物质的量之比为1:1
D.b、d分别与a形成的化合物中,化学键类型一定完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,向20mL 0.1mol/L的CH3COOH溶液中不断滴加0.1mol/L的NaOH溶液,溶液的pH变化曲线如图所示,在滴定过程中,下列关于溶液中离子浓度大小关系的描述不正确的是( )
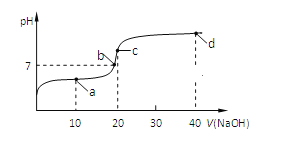
A. a点时:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-)
B. b点时:c(Na+)<c(CH3COO-)
C. c点时:c(OH-)=c(CH3COOH)+ c(H+)
D. d点时:c(Na+)>c(OH-) > c(CH3COO-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
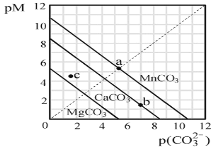
已知pM=-lgc(M),p(CO![]() )=-lgc(CO
)=-lgc(CO![]() )。
)。
A.MgCO3、CaCO3、MnCO3的Ksp依次增大
B.a点可表示MnCO3的饱和溶液,且c(Mn2+)=c(CO![]() )
)
C.b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO![]() )
)
D.c点可表示MgCO3的过饱和溶液,且c(Mg2+)<c(CO![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用化学平衡移动原理解释的是
A.收集氯气可以用排饱和食盐水的方法
B.在一定条件下,氢气与碘蒸汽反应达平衡后,加压,混合气体颜色变深
C.可用浓氨水和氢氧化钠固体快速制取氨气
D.合成三氧化硫过程中使用过量的氧气,以提高二氧化硫的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组反应中,属于可逆反应的一组是( )
A. 2H2O![]() 2H2↑+O2↑,2H2+O2
2H2↑+O2↑,2H2+O2![]() 2H2O
2H2O
B. NH3+CO2+H2O=NH4HCO3,NH4HCO3![]() NH3↑+H2O↑+CO2↑
NH3↑+H2O↑+CO2↑
C. H2+I2![]() 2HI,2HI
2HI,2HI![]() H2↑+I2↑
H2↑+I2↑
D. 2Ag+Br2![]() 2AgBr,2AgBr
2AgBr,2AgBr![]() 2Ag+Br2
2Ag+Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,请用化学用语回答下列问题:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ⑥ | ⑦ | ⑧ | |||||
3 | ① | ③ | ⑤ | ⑨ | ⑩ | |||
4 | ② | ④ |
(1)在③~⑦元素中,原子半径最大的是__________(填元素符号);
(2)⑦元素的最高价氧化物对应的水化物与其氢化物能生成盐M,M中含有的化学键类型有__________________;
(3)写出元素①和⑧的单质在加热条件下反应生成的化合物的电子式:_________。
(4
(5)①~⑨中元素最高价氧化物对应的水化物中酸性最强的是_____________(填物质化学式);呈两性的氢氧化物是_________(填物质化学式),该化合物与NaOH溶液反应的离子方程式为___________。
(6)用电子式表示元素③与⑨形成化合物的过程_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com