
 某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入Fe粉,溶液中Fe2+浓度和加入Fe粉的物质的量之间的关系如如图所示.则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入Fe粉,溶液中Fe2+浓度和加入Fe粉的物质的量之间的关系如如图所示.则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )| A、1:1:1 |
| B、1:1:4 |
| C、1:2:2 |
| D、3:2:8 |
 分析计算.
分析计算.

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
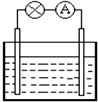
| A、铜为正极 |
| B、锌片上发生氧化反应 |
| C、它是一种把化学能转变为电能的装置 |
| D、电子从铜片流出沿导线流入锌片 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(NH4+)>c(Cl-),c(OH-)>c(H+) |
| B、c(NH4+)=c(Cl-),c(OH-)=c(H+) |
| C、c(Cl-)>c(NH4+),c(OH-)>c(H+) |
| D、c(Cl-)>c(NH4+),c(H+)>c(NH4+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| A、C3N3(OH)3与HNCO为同一物质 |
| B、HNCO是一种很强的氧化剂 |
| C、1 mol NO2在反应中转移的电子为24 mol |
| D、反应中N2既是氧化产物又是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ |
| B、氯气通入澄清石灰水中:Cl2+2OH-═Cl-+ClO-+H2O |
| C、SO2气体通入NaClO溶液中:SO2+2ClO-+H2O═SO32-+2HClO |
| D、硅酸钠溶液中通入过量二氧化碳:SiO32-+CO2+H2O═H2SiO3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
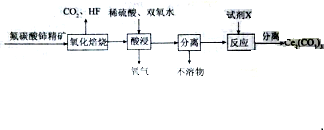
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com