
下列叙述中不正确的是( )
A.Fe在少量Cl2中燃烧生成FeCl2,在足量Cl2中燃烧生成FeCl3
B.在空气中用小火慢慢加热蒸干硫酸亚铁溶液,不会得到纯净的硫酸亚铁固体,
C.鉴别Fe2+和Fe3+,可以使用酸性KMnO4溶液 ,也可使用KI淀粉溶液
D.Fe3+有氧化性,所以可以用FeCl3溶液来回收旧电路板中的铜
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
用已知物质的量浓度的NaOH溶液测定未知物质的量
浓度的盐酸,其操作错误的是 ( )
A.酸式滴定管需用待测盐酸润洗 B.碱式滴定管不用标准碱液润洗
C.滴定过程中不能有液体从锥形瓶溅出 D.滴定结束,读数时要平视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式中属于水解反应,而且可使溶液呈酸性的是:
A. HS- + H2O S2- + H3O+
S2- + H3O+
B. CO2+H2O HCO3- + H+
HCO3- + H+
C. HCO3—+H2O CO32—+H3O+
CO32—+H3O+
D.NH4++2H2O NH3·H2O+H3O+
NH3·H2O+H3O+
| |
查看答案和解析>>
科目:高中化学 来源: 题型:
到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源。
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为 。
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关。
已知:H2 (g) + Cl2 (g) = 2HCl (g) △H=-185kJ/mol
E(H—H) = 436kJ/mol E(Cl—Cl) = 243kJ/mol
则E(H—Cl) =
(3)纳米级Cu2O由于具有优良的催化性能而受到关注。已知:
2Cu(s) + O2(g) === Cu2O(s) ΔH=-169kJ·mol-1,
C(s)+ O2(g) === CO(g) ΔH=-110.5kJ·mol-1,
2Cu(s)+ O2(g)=== 2CuO(s) ΔH=-314kJ·mol-1
则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式为 。
(4)如下图是N2和H2反应生成2 mol NH3过程中能量变化示意图,请计算每生成1mol NH3放出热量为: 。

查看答案和解析>>
科目:高中化学 来源: 题型:
某物质灼烧时,焰色反应为黄色,下列判断正确的是( )
A.该物质一定是钠的化合物 B. 该物质一定是金属钠
C.该物质一定含钠元素 D.可确定该物质中不含钾元素
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期金属元素甲~戊在元素周期表的相对位置如表所示。下列判断正确的是( )
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
A.原子半径:丙<丁<戊
B.金属性:甲>丙
C.氢氧化物碱性:丙>丁>戊
D.最外层电子数:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D四种短周期元素的原子序数依次增大。A、D同族,B、C同周期。C是地壳中含量最多的元素。A、B组成的化合物甲为气态,其中A、B原子数之比为4:1。由A、C组成两种化合物乙和丙均为液态,乙中A、C原子数之比为1:1,丙中为2:1;由D、C组成的两种化合物丁和戊均为固态,丁中原子数比为1:1,戊中2:1。
(1)B位于周期表中的第二周期第 族。
(2)乙、丙、丁、戊中既有极性键又有非极键的是 (填化学式)
(3)由A、C元素组成的10e-阴离子的电子式为: 。
(4)写出乙在催化剂作用下分解成C单质气体的方程式: 。
(5)写出丙和丁反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g) 2NH3(g) △H=-92.6kJ/moL。实验测得起始、平衡时得有关数据如下表:
2NH3(g) △H=-92.6kJ/moL。实验测得起始、平衡时得有关数据如下表:
| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体 系能量的变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量:23.15kJ |
| ② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述错误的是
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为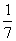
C.容器②中达平衡时放出的热量Q=23.15 kJ
D.若容器①体积为0.5L,则平衡时放出的热量<23.15kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为周期表的一部分,其中的编号代表对应的元素。
 |
请回答下列问题:
(1)表中属于d区元素的是 (填编号)。
(2)写出基态⑨原子的电子排布式 。
(3)元素⑦形成的RO32- 含氧酸根的立体构型是 ,其中心原子的杂化轨道类型是 。
(4)元素①的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是 。
A.分子中含有氢键 B.属于非极性分子
C.含有4个σ键和1个π键 D.该氢化物分子中,①原子采用sp2杂化
(5)元素⑦(用X表示)的氢化物和元素③(用Y表示)的一种氢化物的主要物理性质比较如下:
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2X | 187 | 202 | 2.6 |
| H2Y2 | 272 | 423 | 以任意比互溶 |
H2X和H2Y2相对分子质量基本相同,造成上述物理性质差异的主要原因
、 。
 (6)元素④和⑧形成的化合物,其立方晶胞结构如右图所示,则该化合物的化学式是 。若该化合物晶体的密度为a g·cm-3,阿伏加德罗常数为6.02×1023,则晶胞的体积是__________(只要求列出算式)。
(6)元素④和⑧形成的化合物,其立方晶胞结构如右图所示,则该化合物的化学式是 。若该化合物晶体的密度为a g·cm-3,阿伏加德罗常数为6.02×1023,则晶胞的体积是__________(只要求列出算式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com