
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g) 2NH3(g) △H=-92.6kJ/moL。实验测得起始、平衡时得有关数据如下表:
2NH3(g) △H=-92.6kJ/moL。实验测得起始、平衡时得有关数据如下表:
| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体 系能量的变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量:23.15kJ |
| ② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述错误的是
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为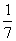
C.容器②中达平衡时放出的热量Q=23.15 kJ
D.若容器①体积为0.5L,则平衡时放出的热量<23.15kJ
科目:高中化学 来源: 题型:
用等体积的的 1 mol·L-1的BaCl2溶液,可使相同体积的Na2SO4 、Fe2(SO4)3 、KAl(SO4)2三种溶液中的SO42-完全沉淀,则三种硫酸盐的物质的量浓度之比为 ( )
A.1︰3︰2 B.6︰2︰3 C.1︰1︰1 D.3︰1︰2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中不正确的是( )
A.Fe在少量Cl2中燃烧生成FeCl2,在足量Cl2中燃烧生成FeCl3
B.在空气中用小火慢慢加热蒸干硫酸亚铁溶液,不会得到纯净的硫酸亚铁固体,
C.鉴别Fe2+和Fe3+,可以使用酸性KMnO4溶液 ,也可使用KI淀粉溶液
D.Fe3+有氧化性,所以可以用FeCl3溶液来回收旧电路板中的铜
查看答案和解析>>
科目:高中化学 来源: 题型:
下列比较正确的是
① 与冷水的反应速率:K>Na>Mg ② 热稳定性:HF>H2Se>H2S
③ 离子半径:Cl->O2->Al3+ ④ 结合质子的能力:CH3CH2O->CH3COO->HCO3-
A.②④ B.②③ C.①④ D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
向CuSO4溶液中逐滴加入过量KI溶液,观察到产生白色沉淀,溶液变为棕色。再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色。则下列分析中正确的是
A.白色沉淀是CuI2,棕色溶液含有I2
B.滴加KI溶液时,转移1mole-时生成1mol白色沉淀
C.通入SO2时,SO2与I2反应,I2作还原剂
D.上述实验条件下,物质的氧化性:Cu2+>I2>SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸工业中通常将尾气转化为硫酸铵,既能防止对大气的污染,又能充分利用原料。
请回答下列问题:
⑴ 硫酸工业尾气中SO2、O2的体积分数分别为0.4%和0.5%。向硫酸工业尾气中通入空气(设空气中O2的体积分数为20.5%,且不含SO2),使SO2的体积分数由0.4%降为0.2%。
① 通入的空气与原硫酸工业尾气的体积比为 ▲ 。
② 通入的空气后的混合气体中O2的体积分数为 ▲ 。
⑵ 在400℃时,将经上述通入空气后的硫酸工业尾气以5×103L/h的速率通过V2O5催化剂层后,再与NH3混合,同时缓慢喷入冷水,此时气体温度迅速由约400℃下降为200℃,在热的结晶装置中得到(NH4)2SO4晶体。
① 生产中,NH3的通过速率约为 ▲ L/h时,原子利用率最高(设SO2的转化率为100%)。
② 某硫酸厂每天排放出的尾气折算成标准状况下的体积为5×105m3。按上述方法该厂每月(以30天计)最多能获得多少吨硫酸铵?
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列溶液中,各组离子一定能够大量共存的是( )
A.使酚酞变红的溶液:Na+ Cl- SO42- AlO2-
B.某无色溶液:CO32- NO3- Al3+ Ba2+
C.加入Al能放出H2的溶液中 NH4+、Cl-、Na+、SO42-
D.酸性溶液中: NO3-、SO32-、Na+、Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
向100ml 1mol/L 的Al2(SO4)3 溶液中加入100ml NaOH溶液,得到7.8克白色沉淀,请问NaOH溶液物质的量浓度可能是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
在25℃下,将a mol·L-1的CH3COONa与0.02 mol·L-1的盐酸等体积充分混合,反应后测得溶液pH=7,则:
(1)a ▲ 0.02(填“<”、“>”或“=”);
(2)c(CH3COO-)+ c(CH3COOH)= ▲ mol·L-1,c(CH3COOH)= ▲ mol·L-1;
(3)CH3COOH的电离平衡常数Ka= ▲ (用含a的代数式表达)。
(4)反应后溶液中各种离子浓度由大到小顺序是 ▲
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com