
【题目】利用下图所示装置进行下列实验,其中丙中实验现象描述正确的是( )
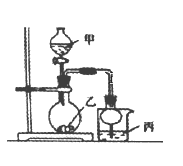
实验 | 试剂甲 | 试剂乙 | 试剂丙 | 丙中的现象 |
A | 浓硫酸 | Na2SO3 | 紫色石蕊试液 | 溶液先变红后褪色 |
B | 浓盐酸 | KMnO4 | 淀粉—KI溶液 | 溶液变蓝 |
C | 稀盐酸 | CaCO3 | BaCl2溶液 | 有白色沉淀生成 |
D | 浓氨水 | CaO | AlCl3溶液 | 先生成白色沉淀然后沉淀溶解 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.钠和冷水反应:Na+2H2O=Na++2OH-+H2↑
B.金属铝溶于氢氧化钠溶液:Al+2OH-=![]() +H2↑
+H2↑
C.金属铝溶于盐酸中:2Al+6H+=2Al3++3H2↑
D.碳酸氢钠溶液中滴入少量的氢氧化钙溶液:HCO3-+OH-= CO32-+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是极弱的电解质,改变温度或加入某些电解质会影响水的电离。请回答下列问题:
(1)纯水在100 ℃时,pH=6,该温度下0.1 mol·L-1的NaOH溶液的pH=_____________。
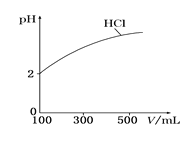
(2)体积均为100 mL、pH均为2的盐酸与一元弱酸HX,加水稀释过程中盐酸的pH与溶液体积的关系如图所示,则在图上画出HX加水至500mL稀释过程中pH值的变化曲线_____,并说明理由___________。
(3)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离平衡常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7,K2=5.6×10-11 |
25 ℃时,在0.5 mol·L-1的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的_____倍。
(4)写出在NaCN溶液中通入少量CO2反应的离子方程式________________________。
(5)某兴趣小组为研究碳酸钠水解平衡与温度的关系,用数字实验系统测定一定浓度碳酸钠溶液的pH与温度的关系,得到曲线如图,下列分析合理的是___________。
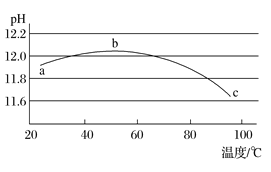
A 碳酸钠水解是吸热反应 B ab段说明水解平衡向右移动
C bc段说明水解平衡向左移动 D 水的电离平衡也对pH产生影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化锰在工业上具有重要的作用,工业上可利用菱锰矿(主要成分为MnCO3、SiO2、FeCO3以及少量CuO)制取。制备流程如图所示:
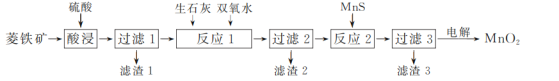
(1)酸浸过程中,MnCO3溶解的离子方程式为______,选择用硫酸而不选择盐酸溶解,除了盐酸挥发造成设备腐蚀以外,另一个原因是________。
(2)滤渣3的主要成分是________,除铁的过程中,应该先加________(填“生石灰”或“双氧水”),原因是__________。
(3)用惰性电极对过滤3得到的滤液进行电解,得到MnO2,写出电解过程中阳极电极反应式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属(M)空气电池的工作原理如图所示。下列说法正确的是( )
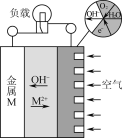
A.金属M作电池正极
B.电解质是熔融的MO
C.电路中转移2 mol电子,理论上约消耗空气56 L
D.电池总反应为2M+O2+2H2O=2M(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。
(1)已知:N2(g)+O2(g)=2NO(g);ΔH1=+180.5 kJ·mol-1
C(s)+O2(g)=CO2(g);ΔH2=-393.5 kJ·mol-1
2C(s)+O2(g)=2CO(g);ΔH3=-221 kJ·mol-1
反应2NO(g)+2CO(g)N2(g)+2CO2(g)的ΔH=________ kJ·mol-1。
(2)催化氧化法去除NO是在一定条件下,用NH3消除NO污染,其反应原理为4NH3+6NO![]() 5N2+6H2O。不同温度条件下,n(NH3)∶n(NO)的物质的量之比分别为4∶1、3∶1、1∶3时,得到NO脱除率曲线如图所示:
5N2+6H2O。不同温度条件下,n(NH3)∶n(NO)的物质的量之比分别为4∶1、3∶1、1∶3时,得到NO脱除率曲线如图所示:
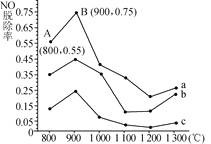
①n(NH3)∶n(NO)的物质的量之比为1∶3时,对应的是曲线________(填“a”“b”或“c”)。
②由图可知,无论以何种比例反应,在温度超过900℃时NO脱除率都会骤然下降的原因可能是____________。
(3)NO氧化反应:2NO(g)+O2(g)2NO2(g)分两步进行,其反应过程能量变化示意图如图:

Ⅰ. 2NO(g)→N2O2(g);ΔH1
Ⅱ. N2O2(g)+O2(g)→2NO2(g);ΔH2
①化学反应速率有速率较慢的反应步骤决定。以上反应决定NO氧化反应速率的步骤是________(填“Ⅰ”或“Ⅱ”)。
②在恒容的密闭容器中充入一定量的NO和O2气体,保持其他条件不变,控制反应温度分别为T3和T4(T4>T3),测得c(NO)随t(时间)的变化曲线如图。转化相同量的NO,在温度_____(填“T3”或“T4”)下消耗的时间较长,试结合反应过程能量图分析其原因:______。

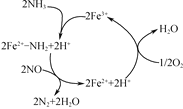
(4) NH3催化还原NO是重要的烟气脱硝技术,其反应过程与能量关系如图:

研究发现在以Fe2O3为主的催化剂上可能发生的反应过程如图,写出脱硝过程的总反应方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:

(1)从反应开始到10 s时,用Z表示的反应速率为 ,X的物质的量浓度减少了 ,Y的转化率为 。
(2)该反应的化学方程式为
(3)10 s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图像如图所示:

则下列说法符合该图像的是 。
A.t1时刻,增大了X的浓度 B.t1时刻,升高了体系温度
C.t1时刻,缩小了容器体积 D.t1时刻,使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列各题:
(1)现有下列9种物质:①氯气;②二氧化硫;③氢氧化铁胶体;④铁;⑤氯化钡;⑥氢氧化钾;⑦氯化铁溶液;⑧酒精(C2H5OH);⑨氧化钙。
用相应化学式填写下列空白:属于酸性氧化物的有____,属于电解质的是______,属于非电解质的_______。(用相应化学式填空)
下列关于③和⑦的说法正确的是____(填字母序号)。
a.都不稳定,密封静置会产生沉淀 b.③能产生丁达尔效应,而⑦不能
c.分散质粒子都可以通过滤纸 d.加入盐酸都会先产生沉淀,后溶解
(2)标准状况下,2.24 L Cl2的质量为__________;有__________个氯原子。
(3)10.8g R2O5中氧原子的数目为3.01×1023, 则元素R的相对原子质量为________;R元素名称是_______。
(4)如果a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是(设NA为阿伏加德罗常数)______________。
(5)由CH4和O2的组成的混和气体,在标况下的密度是H2的14.5倍。则该混合气体中CH4和O2的体积比为_______。
(6)物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当溶液体积比为5∶3∶2时,三种溶液中c(Cl)之比为____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟及其化合物用途非常广泛。回答下列问题:
(1)聚四氟乙烯是一种准晶体,准晶体是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过______方法区分晶体准晶体和非晶体。
(2)基态F原子的价层电子排布图(轨道表达式)为______。
(3)[H2F]+[SbF6]-(氟锑酸)是一种超强酸,存在[H2F]+,该离子的空间构型为______,与[H2F]+具有相同空间构型和键合形式的分子和阴离子分别是______(各举一例)。
(4)NH4F(氟化铵)可用于玻璃的蚀刻防腐剂、消毒剂。NH4+中中心原子的杂化类型是______;氟化铵中存在______(填字母)。
A.离子键B.σ键C.π键D.氢键
(5)SF6被广泛用作高压电气设备的绝缘介质。SF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图(a)计算相关键能。则F-F键的键能为______kJmol-1,S-F键的键能为______kJmol-1。
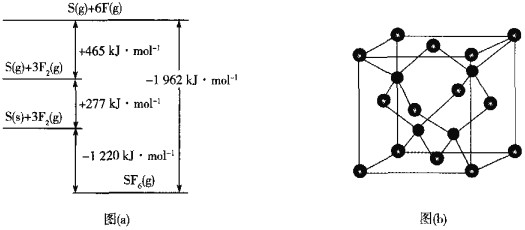
(6)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃,密度为7.1gcm-3。
①CuF的熔点比CuCl的高,原因是______
②已知NA为阿伏加德罗常数的值,CuF的晶胞结构如图(b)所示,则CuF的晶胞参数a=______nm(列出计算式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com