
| A. | ④<①<③<② | B. | ①<④<③<② | C. | ①<②<③<④ | D. | ④<③<①<② |
分析 根据溶液的酸碱性以及利用盐类的水解程度来确定溶液中pH大小,酸的酸性越弱则酸的酸根离子水解程度越大,则相同浓度的钠盐溶液其pH越大.
解答 解:①醋酸钠是强碱弱酸盐,醋酸根离子水解而使其溶液呈碱性;
②硫酸氢钠是强酸酸式盐,在水溶液里完全电离而使其溶液呈强酸性;
③氯化钠是强酸强碱盐,钠离子和氯离子都不水解,则其水溶液呈中性;
④酚钠是强碱弱酸盐,酚氧根离子水解而使其溶液呈碱性;
醋酸的酸性大于苯酚,所以酚氧根水解程度大于醋酸根离子,则相同浓度的醋酸钠和酚钠溶液,酚钠的pH都大于醋酸钠,则这几种溶液中pH从大到小顺序是:酚钠>醋酸钠>氯化钠>硫酸氢钠,④<①<③<②,
故选A.
点评 本题考查了pH的大小比较,明确盐的类型及盐类水解程度是解本题关键,硫酸氢钠在水溶液里电离出钠离子、氢离子和硫酸根离子,硫酸氢钠在熔融状态下电离出钠离子和硫酸氢根离子,注意硫酸氢钠在水溶液里或熔融状态下电离的不同,为易错点,题目难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
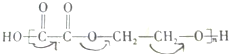 )是一种重要的化工原料,某种由A制备G的工艺流程如下,请回答:
)是一种重要的化工原料,某种由A制备G的工艺流程如下,请回答: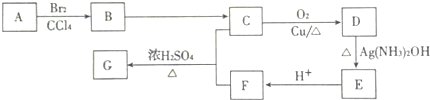
 +(2n-1)H2O.
+(2n-1)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,23 g NO2含有0.5NA个氮原子 | |
| B. | 1L 0.1 mol•L-1硫酸铵溶液中含有0.1NA个NH4+ | |
| C. | 常温常压下,22.4 L CCl4含有NA个CCl4分子 | |
| D. | 1mol Fe2+与足量的H2O2溶液反应,转移2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的比例模型: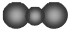 | |
| B. | 氢化铵(NH4H)电子式: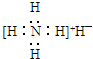 | |
| C. | (CH3)3COH的名称:2,2-二甲基乙醇 | |
| D. | 乙酸乙酯的水解CH3COOCH2CH3+H218O $?_{△}^{酸}$CH3CO18OH+CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.448L | B. | 0.336L | C. | 0.224L | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
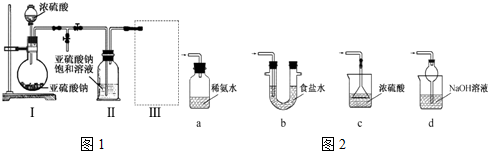

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
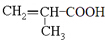 ,PMAA是一种“智能型”高分子材料,可用于生物制药中大分子和小分子的分离.已知反应:R-Br+NaOH$→_{△}^{水}$ROH+NaBr.
,PMAA是一种“智能型”高分子材料,可用于生物制药中大分子和小分子的分离.已知反应:R-Br+NaOH$→_{△}^{水}$ROH+NaBr.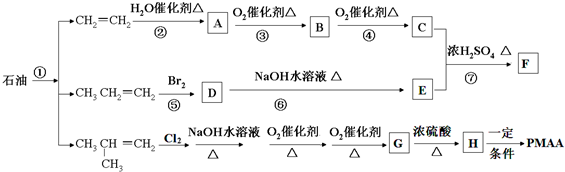
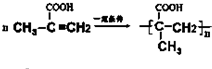 .
.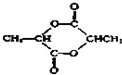 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com