
海水中蕴藏着丰富的资源。海水综合利用的示意图如下。

下列说法正确的是
A.通过氯碱工业可生产的产品有NaOH、NaClO、盐酸等。
B.卤水经过蒸发结晶可直接得到较纯净的MgCl2·6H2O晶体
C.粗盐精制的过程只发生物理变化
D.在高温下用氢气还原MgCl2可制取金属镁
 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
下列叙述中,正确的有几句( )
①电解池是将化学能转变为电能的装置
②原电池是将电能转变成化学能的装置
③金属和石墨导电均为物理变化,电解质溶液导电是化学变化
④不能自发进行的氧化还原反应,通过电解的原理有可能实现
⑤电镀过程相当于金属的“迁移”,可视为物理变化
A.4 B.3 C.2 D.1
查看答案和解析>>
科目:高中化学 来源: 题型:
若40 g密度为ρ g•cm-3的硝酸钙溶液里含1 g Ca2+,则NO3-的物质的量浓度是( )。
A.ρ/400 mol•L-1 B.20ρmol•L-1
C.2.5ρ mol•L-1 D.1.25ρ mol•L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
研究性学习小组进行SO2的制备及性质探究实验。
⑴ 根据反应Na2SO3(固) + H2SO4(浓) == Na2SO4 + SO2↑+H2O,制备SO2气体。
用下列简图,在答题卡的方框中画出制备并收集SO2的实验装置(含试剂)示意图。
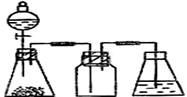
② 实验过程中,使用分液漏斗滴加浓硫酸的操作是__________________________。
⑵ 将SO2气体分别通入下列溶液中:
① 品红溶液,现象是__________________________________________________。
② 溴水溶液,现象是_________________________________________________。
③ 硫化钠溶液,现象是________________________________________________。
⑶ 有一小组在实验中发现,SO2氧化产生缓慢,以致后续实验现象很不明显,但又不存在气密性问题。请你推测可能的原因并说明相应的验证方法(可以不填满)
① 原因_______________________,验证方法________________________________。
② 原因_______________________,验证方法________________________________。
③ 原因_______________________,验证方法________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学活动课上,三组学生分别用图示甲、乙两装置,探究“NaHCO3和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查)。
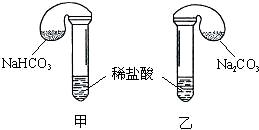
请回答:
(1)各组反应开始时,________装置中的气球体积先变大,该装置中反应的离子方程式是___________________________。
(2)当试管中不再有气体生成时,三组实验出现不同现象,填写下表的空格。
| 试剂用量 | 实验现象 (气球体积变化) | 分析原因 | |
| 第 ① 组 | 0.42 g NaHCO3 0.53 g Na2CO3 3 mL 4 mol/L盐酸 | 甲中气球与乙中气球的体积相等 | 甲、乙盐酸均过量 n(NaHCO3)=n(Na2CO3) V甲(CO2)=V乙(CO2) |
| 第 ② 组 | 0.3 g NaHCO3 0.3 g Na2CO3 3 mL 4 mol/L盐酸 | 甲中气球比乙中气球的体积大 | |
| 第 ③ 组 | 0.6 g NaHCO3 0.6 g Na2CO3 3 mL 2 mol/L盐酸 | 甲中气球比乙中气球的体积大 | |
| 片刻后,乙中气球又缩小,甲中气球的体积基本不变 | (用离子方程式表示) |
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下的两种溶液:①pH=9的NaOH溶液,②pH=9的CH3COONa溶液。对这两种溶液的判断,正确的是
A.两溶液中水的电离程度相同
B.c(Na+):①>②
C.两溶液分别用水稀释10倍后,pH①=pH②<9
D.将①和②等体积混合后的溶液:c(Na+)=c(CH3COO-)+c(OH-)-c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
298K时,在FeCl3酸性溶液中加少量锌粒后,Fe3+ 立即被还原成Fe2+。据此某学习小组设计如图所示的原电池装置。下列有关说法正确的是
A.正极反应为Zn–2e-=Zn2+
B.左烧杯中溶液的红色变浅
C.Pt电极上有气泡出现
 D.该电池总反应为3Zn + 2Fe3+ = 2Fe + 3Zn2+
D.该电池总反应为3Zn + 2Fe3+ = 2Fe + 3Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
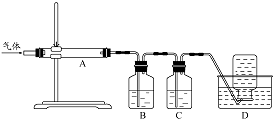 纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:

(1)MgCO3与稀硫酸反应的离子方程式为 。
(2)加入H2O2氧化时,发生反应的化学方程式为 。
(3)滤渣2的成分是 (填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用右图装置对煅烧产生的气体进行分步吸收或收集。
①D中收集的气体可以是 (填化学式)。
②B中盛放的溶液可以是 (填字母)。
a.NaOH 溶液 b.Na2CO3溶液 c.稀硝酸 d.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.稀硝酸、稀硫酸均能将木炭氧化成二氧化碳
B.Na2O2与水反应、红热的Fe与水蒸气反应均能生成碱
C.Li、C、P分别在足量氧气中燃烧均生成一种相应氧化物
D.NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com