
化学活动课上,三组学生分别用图示甲、乙两装置,探究“NaHCO3和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查)。
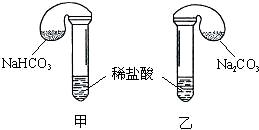
请回答:
(1)各组反应开始时,________装置中的气球体积先变大,该装置中反应的离子方程式是___________________________。
(2)当试管中不再有气体生成时,三组实验出现不同现象,填写下表的空格。
| 试剂用量 | 实验现象 (气球体积变化) | 分析原因 | |
| 第 ① 组 | 0.42 g NaHCO3 0.53 g Na2CO3 3 mL 4 mol/L盐酸 | 甲中气球与乙中气球的体积相等 | 甲、乙盐酸均过量 n(NaHCO3)=n(Na2CO3) V甲(CO2)=V乙(CO2) |
| 第 ② 组 | 0.3 g NaHCO3 0.3 g Na2CO3 3 mL 4 mol/L盐酸 | 甲中气球比乙中气球的体积大 | |
| 第 ③ 组 | 0.6 g NaHCO3 0.6 g Na2CO3 3 mL 2 mol/L盐酸 | 甲中气球比乙中气球的体积大 | |
| 片刻后,乙中气球又缩小,甲中气球的体积基本不变 | (用离子方程式表示) |
科目:高中化学 来源: 题型:
2012年3月22日是第二十届“世界水日”,保护水资源,从我做起!
(1)C102和C12(还原产物都为Cl一)是生活中常用的消毒剂。当消耗等物质的量的两种物质时,C102的消毒效率是C12的 倍。
(2)自来水厂常用高铁酸钠(Na2Fe04,强氧化剂)改善水质。简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理: .
(3)某无色废水中可能含有Fe3+、A13+、Mg2+、Na+、NO3-、CO32一、SO42-离子中的几种,为分析其成分,分别取废水样品100 mL,进行了三组实验,其操作和有关现象如图所示:
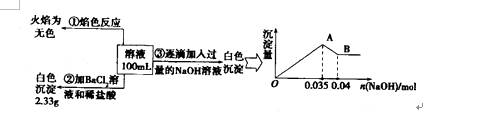
请根据上图回答下列问题:
①实验中需配制1.0 mol/l的NaOH溶液80 ml,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器为
②实验③中沉淀量由A→B过程中所发生反应的离子方程式为 。
③试确定NO3-是否存在? (填“存在”“不存在”或“不确定”),若存在,试计算
c(NO3-) (若不存在,此问不必作答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质之间的转化能一步实现的是( )。
A.Na2CO3 →NaOH B.CaCO3 →Ca(OH)2
C.NaNO3 →NaCl D.FeSO4 →CuSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
题适用于二期课改新教材,B题适用于一期课改教材。
(A)我国化学家候德榜(右下图)改革国外的纯碱生产工艺,生产流程可简要表示如下:
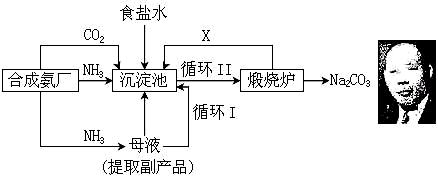
(1) 上述生产纯碱的方法称 ,副产品的一种用途为 。
(2) 沉淀池中发生的化学反应方程式是 。
(3) 写出上述流程中X物质的分子式 。
(4) 使原料氯化钠的利用率从70%提高到90%以上,主要是设计了 (填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是 。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加 。
(6) 向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 。
(a) 增大NH4+的浓度,使NH4Cl更多地析出
(b) 使NaHCO3更多地析出
(c) 使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(B)某化学课外小组用下图装置制取溴苯。
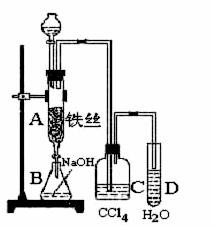
先向分液漏斗中加入苯和液溴 ,再将混合液慢慢滴入反应器A(A下端活塞)中。
(1)写出A中反应的化学方程式
(2)观察到A中的现象是 。
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是 ,写出有关的化学方程式 。
(4)C中盛放CCl4的作用是 。
(5)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入 ,现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取
FeCl3·6H2O晶体。(图中夹持及尾气处理装置均己略去)
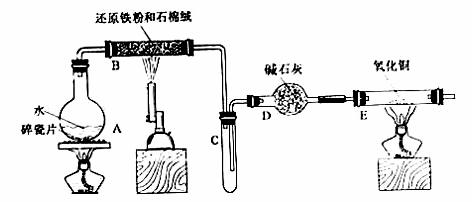
(1)装置B中发生反应的化学方程式是___________________________。
(2)装置B中的现象是________________________________________。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法:________________________。
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
滤液 FeCl3溶液
FeCl3溶液 FeCl3·6H2O晶体
FeCl3·6H2O晶体
①步骤Ⅰ中通入Cl2的作用是____________________________________。
②步骤Ⅱ从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:
_____________________________________________________________。
③该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明)
_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
海水中蕴藏着丰富的资源。海水综合利用的示意图如下。

下列说法正确的是
A.通过氯碱工业可生产的产品有NaOH、NaClO、盐酸等。
B.卤水经过蒸发结晶可直接得到较纯净的MgCl2·6H2O晶体
C.粗盐精制的过程只发生物理变化
D.在高温下用氢气还原MgCl2可制取金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
现有下列六个转化,其中不能通过一步反应实现的是
①SiO2→Na2SiO3; ②SiO2→H2SiO3 ③CuSO4→Cu(NO3)2;;
④CuO→Cu(OH)2; ⑤Cl2→NaClO ⑥SO2 →H2SO4
A.①②⑥ B.②③④ C.③④⑤ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于实验室制备乙酸乙酯和乙酸丁酯的描述正确的是
A.均采用水浴加热 B.制备乙酸乙酯时正丁醇过量
C.均采用边反应边蒸馏的方法 D.制备乙酸乙酯时乙醇过量
查看答案和解析>>
科目:高中化学 来源: 题型:
从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
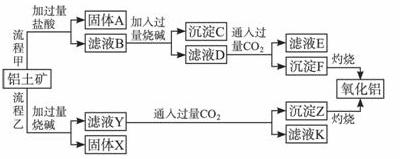
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为______________________________。
(2)流程乙加入烧碱后生成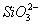 的离子方程式为_____________________________。
的离子方程式为_____________________________。
(3)验证滤液B含Fe3+,可取少量滤液并加入_______________(填试剂名称)。
(4)滤液E、K中溶质的主要成分是_______________(填化学式),写出该溶质的一种用途_______________。
(5)已知298 K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12。取适量的滤液B,加入一定量的烧碱至达到沉淀溶解平衡,测得pH=13.00,则此温度下残留在溶液中的c(Mg2+)=__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com