
现有下列六个转化,其中不能通过一步反应实现的是
①SiO2→Na2SiO3; ②SiO2→H2SiO3 ③CuSO4→Cu(NO3)2;;
④CuO→Cu(OH)2; ⑤Cl2→NaClO ⑥SO2 →H2SO4
A.①②⑥ B.②③④ C.③④⑤ D.②④
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病。碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水。碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘。以碘为原料,通过电解制备碘酸钾的实验装置如图所示。请回答下列问题

(1)碘是_________(填颜色)固体物质,实验室常用_________方法来分离提纯含有少量杂质的固体碘。
(2)电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却。电解时,阳极上发生反应的电极反应式为______________________;阴极上观察到的实验现象是____________________。
(3)电解过程中,为确定电解是否完成,需检验电解液中是否有I-。请设计一个检验电解液中是否有
I-的实验方案,并按要求填写下表。
要求:所需药品只能从下列试剂中选择,实验仪器及相关用品自选。试剂:淀粉溶液、碘化钾淀粉试纸、过氧化氢溶液、稀硫酸。
①实验方法 。
②实验现象及结论: 。
(4)电解完毕,从电解液中得到碘酸钾晶体的实验过程如下
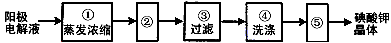
步骤②的操作名称是________________,步骤⑤的操作名称是___________。步骤④洗涤晶体的目的是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
由CO2、H2组成的混合气在同温、同压下与氮气的密度相同。则该混合气体中CO2、H2气体的体积比为( )。
A.29∶8 B.22∶1 C.13∶8 D.8∶13
查看答案和解析>>
科目:高中化学 来源: 题型:
化学活动课上,三组学生分别用图示甲、乙两装置,探究“NaHCO3和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查)。
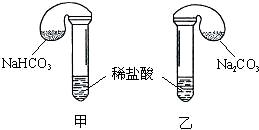
请回答:
(1)各组反应开始时,________装置中的气球体积先变大,该装置中反应的离子方程式是___________________________。
(2)当试管中不再有气体生成时,三组实验出现不同现象,填写下表的空格。
| 试剂用量 | 实验现象 (气球体积变化) | 分析原因 | |
| 第 ① 组 | 0.42 g NaHCO3 0.53 g Na2CO3 3 mL 4 mol/L盐酸 | 甲中气球与乙中气球的体积相等 | 甲、乙盐酸均过量 n(NaHCO3)=n(Na2CO3) V甲(CO2)=V乙(CO2) |
| 第 ② 组 | 0.3 g NaHCO3 0.3 g Na2CO3 3 mL 4 mol/L盐酸 | 甲中气球比乙中气球的体积大 | |
| 第 ③ 组 | 0.6 g NaHCO3 0.6 g Na2CO3 3 mL 2 mol/L盐酸 | 甲中气球比乙中气球的体积大 | |
| 片刻后,乙中气球又缩小,甲中气球的体积基本不变 | (用离子方程式表示) |
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钠(Na2FeO4)可以对饮用水进行净化处理,可由下列方法制得: Fe2O3+3Na2O2  2Na2FeO4+Na2O,关于该反应说法正确的是
2Na2FeO4+Na2O,关于该反应说法正确的是
A.Na2FeO4属于共价化合物 B.反应中Na2O2是氧化剂
C.生成1 mol Na2FeO4,有6 mol 电子转移
D.在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌
查看答案和解析>>
科目:高中化学 来源: 题型:
298K时,在FeCl3酸性溶液中加少量锌粒后,Fe3+ 立即被还原成Fe2+。据此某学习小组设计如图所示的原电池装置。下列有关说法正确的是
A.正极反应为Zn–2e-=Zn2+
B.左烧杯中溶液的红色变浅
C.Pt电极上有气泡出现
 D.该电池总反应为3Zn + 2Fe3+ = 2Fe + 3Zn2+
D.该电池总反应为3Zn + 2Fe3+ = 2Fe + 3Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
H2O2在工业、农业、医药上都有广泛的用途。
(1)许多物质都可以做H2O2分解的催化剂。一种观点认为:在反应过程中催化剂先被H2O2氧化(或还原),后又被H2O2还原(或氧化)。下列物质都可做H2O2分解的催化剂,在反应过程中先被氧化,后被还原的是 。
a、 I- b、 Fe3+ c、 Cu2+ d、 Fe2+
(2)用碱性氢氧燃料电池合成H2O2,具有效率高,无污染等特点。电池总反应为:
H2 + O2 + OH-=H2O + HO2-。写出正极反应式: 。
(3)H2O2是一种环境友好的强氧化剂。电镀废水(主要含Cu2+、Ni2+,还含少量Fe3+、Fe2+、Cr3+ 等)制备硫酸镍的一种流程如下:

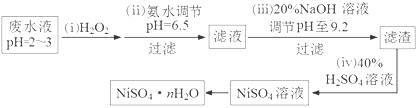
①第(ⅰ)步,加入H2O2反应的离子方程式 。
②为测定NiSO4·nH2O的组成,进行如下实验:称取 2.627g样品,配制成250.00 mL溶液。准确量取配制的溶液25.00 mL,用0.04000 mol·L-1的EDTA(Na2H2Y)标准溶液滴定Ni2+(离子方程式为Ni2++ H2Y2-=NiY2-+ 2H+),消耗EDTA标准溶液25.00 mL。则硫酸镍晶体的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
Ⅰ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验。可选用第试剂KSCN溶液、K3[Fe(CN)6]溶液、氯水。
⑴请完成下表:
| 操作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 | ① | 存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,加入 ② ,振荡 | ③ | 存在Fe2+ |
【实验结论】Fe的氧化产物为存在Fe2+和Fe3+
Ⅱ. AgNO3的热稳定性性
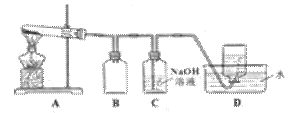 用下图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。当反应结束以后,试管中残留固体为黑色。
用下图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。当反应结束以后,试管中残留固体为黑色。
⑵装置B的作用是 。
⑶经小组讨论并验证该无色气体为O2,其验证方法是 。
⑷【查阅资料】Ag2O和粉末的Ag均为黑色;Ag2O可溶于氨水。
【提出假设】试管中残留的黑色固体可能是:ⅰAg;ⅱ.Ag2O;ⅲ.Ag和Ag2O
【实验验证】该小组为验证上述设想,分别取少量黑色固体,进行了如下实验。
| 实验编号 | 操作 | 现象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硫酸,振荡 | 黑色固体溶解,并有气体产生 |
【实验评价】根据上述实验,不能确定固体产物成分的实验是 ① (填实验编号)。
【实验结论】根据上述实验结果,该小组得出的AgNO3固体热分解的产物有 ② 。
查看答案和解析>>
科目:高中化学 来源: 题型:
由Fe2O3、Fe、CuO、C、Al中的几种物质组成的混合粉末,取样品进行下列实验(部分产物略去):
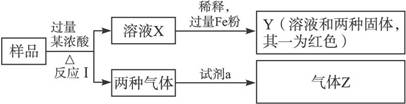
(1)取少量溶液X,加入过量的NaOH溶液,有沉淀生成。取上层清液,通入CO2,无明显变化,说明样品中不含有的物质是(填写化学式)______________。
(2)Z为一种或两种气体:
①若Z只为一种气体,试剂a为饱和NaHCO3溶液,则反应I中能同时生成两种气体的化学方程式是_______________________________________________________。
②若Z为两种气体的混合物,试剂a为适量水,则Z中两种气体的化学式是_________________。
(3)向Y中通入过量氯气,并不断搅拌,充分反应后,溶液中的阳离子是(填写离子符号)___________________________。
(4)取Y中的溶液,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成。当消耗2 mol I-时,共转移3 mol电子,该反应的离子方程式是___ ______________________。
______________________。
(5)另取原样品,加入足量稀硫酸充分反应。若溶液中一定不会产生Y中的红色固体,则原样品中所有可能存在的物质组合是(各组合中的物质用化学式表示)____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com