
高铁酸钠(Na2FeO4)可以对饮用水进行净化处理,可由下列方法制得: Fe2O3+3Na2O2  2Na2FeO4+Na2O,关于该反应说法正确的是
2Na2FeO4+Na2O,关于该反应说法正确的是
A.Na2FeO4属于共价化合物 B.反应中Na2O2是氧化剂
C.生成1 mol Na2FeO4,有6 mol 电子转移
D.在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌
科目:高中化学 来源: 题型:
有一种燃料电池,所用燃料为H2、空气和CO2,电解质为熔融的K2CO3。电池的总反应式为2H2+O2===2H2O,负极反应为H2+CO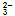 -2e-===H2O+CO2。该电池放电时,下列说法中正确的是( )
-2e-===H2O+CO2。该电池放电时,下列说法中正确的是( )
A.正极反应为2H2O+O2+4e-===4OH- B.CO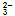 向负极移动
向负极移动
C.电子由正极经外电路流向负极 D.电池中CO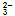 的物质的量将逐渐减少
的物质的量将逐渐减少
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作中错误的是( )。
A.进行蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
B.进行萃取操作时,应选择有机萃取剂
C.进行蒸发操作时,蒸干至当出现大量固体时,应停止加热用余热蒸干
D.进行分液操作时,分液漏斗中下层液体从下口放出后,换一洁净烧杯继续接取上层液体
查看答案和解析>>
科目:高中化学 来源: 题型:
某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取
FeCl3·6H2O晶体。(图中夹持及尾气处理装置均己略去)
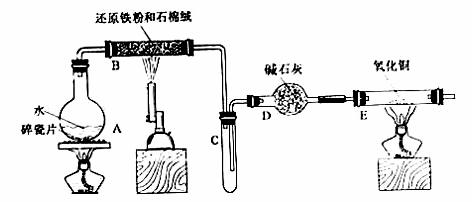
(1)装置B中发生反应的化学方程式是___________________________。
(2)装置B中的现象是________________________________________。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法:________________________。
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
滤液 FeCl3溶液
FeCl3溶液 FeCl3·6H2O晶体
FeCl3·6H2O晶体
①步骤Ⅰ中通入Cl2的作用是____________________________________。
②步骤Ⅱ从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:
_____________________________________________________________。
③该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明)
_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法在一定条件下可以实现的是
①酸性氧化物与碱发生反应 ②弱酸与盐溶液反应可生成强酸 ③没有水生成,也没有沉淀和气体生成的复分解反应 ④两种酸溶液充分反应后的溶液体系为中性 ⑤有单质参加的非氧化还原反应 ⑥两种含氧化合物反应的产物有气体
A.①②③④⑤⑥ B.②④⑤⑥
C.①②③⑤ D.③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
现有下列六个转化,其中不能通过一步反应实现的是
①SiO2→Na2SiO3; ②SiO2→H2SiO3 ③CuSO4→Cu(NO3)2;;
④CuO→Cu(OH)2; ⑤Cl2→NaClO ⑥SO2 →H2SO4
A.①②⑥ B.②③④ C.③④⑤ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
硫代硫酸钠(Na2S2O3)溶液与盐酸混合,生成单质硫并沉淀出来。若将硫代硫酸钠溶液先与界面活性剂(不参与反应)均匀混合于烧杯中,再加人盐酸溶液并立刻搅拌,静置后无沉淀产生,得到含硫单质的腔体(硫分散在体系中)。下列叙述错误的是
A.界面活性剂减缓了硫生成的速率 B.烧杯中单质硫颗粒直径约为 10-9-10-7m
C.硫代硫酸钠与盐酸反应中,盐酸作氧化剂
D.用平行光照射烧杯中液体,将观察到光的“通路”
查看答案和解析>>
科目:高中化学 来源: 题型:
固体硝酸盐加热易分解且产物较复杂。某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想:
甲:Mg(NO3)2、NO2、O2 乙:MgO、NO2、O2 丙:Mg3N2、O2 丁:MgO、NO2、N2
(1)实验前,小组成员经讨论认定猜想丁不成立,理由是_____________。
查阅资料得知:2NO2+2NaOH=NaNO3+NaNO2+H2O
针对甲、乙、丙猜想,设计如下图所示的实验装置(图中加热、夹持仪器等均省略):
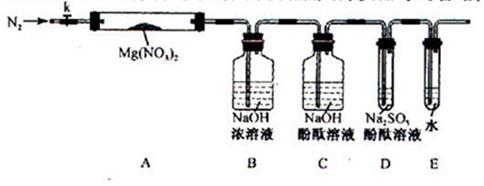
(2)实验过程
①取器连接后,放人固体试剂之前,关闭k,微热硬质玻璃管(A),观察到E 中有气泡连续放出,表明________
② 称取Mg(NO3)2固体3 . 79 g置于A中,加热前通人N2以驱尽装置内的空气,其目的是________;关闭K,用酒精灯加热时,正确操作是先________然后固定在管中固体部位下加热。
③ 观察到A 中有红棕色气体出现,C、D 中未见明显变化。
④ 待样品完全分解,A 装置冷却至室温、称量,测得剩余固体的质量为1 . 0g
⑤ 取少量剩余固体于试管中,加人适量水,未见明显现象。
( 3 )实验结果分析讨论
① 根据实验现象和剩余固体的质量经分析可初步确认猜想_______是正确的。
② 根据D 中无明显现象,一位同学认为不能确认分解产物中有O2,因为若有O2,D中将发生氧化还原反应:_____________________(填写化学方程式),溶液颜色会退去;小组讨论认定分解产物中有O2存在,未检侧到的原因是_____________________。
③ 小组讨论后达成的共识是上述实验设计仍不完善,需改进装里进一步研究。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com