
2012年3月22日是第二十届“世界水日”,保护水资源,从我做起!
(1)C102和C12(还原产物都为Cl一)是生活中常用的消毒剂。当消耗等物质的量的两种物质时,C102的消毒效率是C12的 倍。
(2)自来水厂常用高铁酸钠(Na2Fe04,强氧化剂)改善水质。简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理: .
(3)某无色废水中可能含有Fe3+、A13+、Mg2+、Na+、NO3-、CO32一、SO42-离子中的几种,为分析其成分,分别取废水样品100 mL,进行了三组实验,其操作和有关现象如图所示:
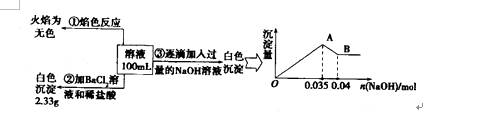
请根据上图回答下列问题:
①实验中需配制1.0 mol/l的NaOH溶液80 ml,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器为
②实验③中沉淀量由A→B过程中所发生反应的离子方程式为 。
③试确定NO3-是否存在? (填“存在”“不存在”或“不确定”),若存在,试计算
c(NO3-) (若不存在,此问不必作答)。
【知识点】常见阳离子的检验,氯、溴、碘及其化合物的综合应用,常见阴离子的检验
【答案解析】(1)2.5 (2分) (2)Fe042-有强的氧化性,能杀菌消毒,本身被还原为Fe3+,Fe3+发生水解生成氢氧化铁胶体,吸附水中的杂质,达到净水的目的;(2分)(3)100 ml容量瓶,②Al(OH)3+OH-=AlO2-+2H2O (2分)③存在,0.15mol/L;
解析:(1)ClO2和Cl2的还原产物都为Cl-,每摩尔Cl2得到2mol电子,而每摩尔ClO2得到5mol电子,则所需Cl2的物质的量是ClO2的2.5倍,故答案为:2.5;
(2)高铁酸钠具有强氧化性,可用于杀菌消毒,还原生成Fe3+,Fe3+发生水解生成氢氧化铁胶体吸附水中的杂质,可用来除去水中的悬浮物,达到净水的目的,
故答案为:FeO42-有强的氧化性,能杀菌消毒,本身被还原为Fe3+,Fe3+发生水解生成氢氧化铁胶体吸附水中的杂质,达到净水的目的;
(3)配制1.0mol/L的NaOH溶液100mL,根据实验步骤所需仪器:玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管、100mL容量瓶;故答案为:100mL容量瓶;
②实验③中A→B过程是Al(OH)3与OH-发生反应,其方程式为:Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
③根据实验①确定无Na+,根据实验②确定有SO42-,根据实验③确定有Al3+无Fe2+,因为CO32-与Al3+不能共存,所以无CO32-;故溶液中存在的离子为:Al3+、SO42-,已知硫酸钡沉淀为2.33g,则n(SO42-)=2.33g/233g/mol=0.01mol,
根据图象可知与Al(OH)3的OH-为:n(OH-)=0.005mol,Al(OH)3 +OH-=AlO2-+2H2O Fe2++2OH-=Fe(OH)2↓ , n(Al3+) 0.005mol n(Fe2+) 0.035-3n(Al3+),所以n(Al3+)=0.005mol,n(Fe2+)=0.01mol 所以溶液中Fe2+和Al3+所带正电荷与SO42-所带负电荷不相等,因此存在NO3-,设NO3-物质的量为n mol,根据电荷守恒得:3n(Al3+)+2n(Fe2+)=2n(SO42-)+n(NO3-)所以n(NO3-)=0.015mol,所以c(NO3-)═0.015mol/0.1L=0.15mol/L,
【思路点拨】本题考查了常见离子检验,现象的判断和离子检验,关键是图象分析离子特征和离子共存的判断,题目难度中等.。


科目:高中化学 来源: 题型:
下列除杂操作可行的是( )
A.通过浓硫酸除去HCl中的H2O
B.通过灼热的CuO除去H2中的CO
C.通过灼热的镁粉除去N2中的O2
D.通过水除去CO中的CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:
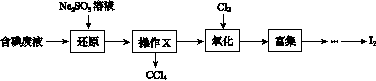
(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为__________________;该操作将I2还原为I-的目的是______________________。
(2)操作X的名称为________。
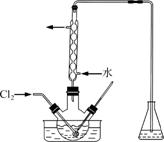
(3)氧化时,在三颈烧瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在40 ℃左右反应(实验装置如图所示)。
实验控制在较低温度下进行的原因是______________;锥形瓶里盛放的溶液为________。
(4)已知:5SO +2IO
+2IO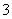 +2H+===I2+5SO
+2H+===I2+5SO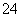 +H2O
+H2O
某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO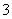 中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO
中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO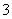 的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出有碘单质存在;________________________________________________________________________
的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出有碘单质存在;________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
在T℃时,将ag NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g/cm3,溶质的质量分数为W,其中含NH4+的物质的量为bmol。下列叙述中正确的是 ( )
A.溶质的质量分数为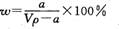
B.上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于O.5w
C.溶液中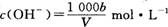
D.溶质的物质的量浓度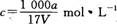
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,反应后固体物质增重的是
A.氢气通过灼热的Cu0粉末
B.二氧化碳通过Na202粉末
C.铝与Fe203发生铝热反应
D.将锌粒投入Cu(N03)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,正确的有几句( )
①电解池是将化学能转变为电能的装置
②原电池是将电能转变成化学能的装置
③金属和石墨导电均为物理变化,电解质溶液导电是化学变化
④不能自发进行的氧化还原反应,通过电解的原理有可能实现
⑤电镀过程相当于金属的“迁移”,可视为物理变化
A.4 B.3 C.2 D.1
查看答案和解析>>
科目:高中化学 来源: 题型:
碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病。碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水。碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘。以碘为原料,通过电解制备碘酸钾的实验装置如图所示。请回答下列问题

(1)碘是_________(填颜色)固体物质,实验室常用_________方法来分离提纯含有少量杂质的固体碘。
(2)电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却。电解时,阳极上发生反应的电极反应式为______________________;阴极上观察到的实验现象是____________________。
(3)电解过程中,为确定电解是否完成,需检验电解液中是否有I-。请设计一个检验电解液中是否有
I-的实验方案,并按要求填写下表。
要求:所需药品只能从下列试剂中选择,实验仪器及相关用品自选。试剂:淀粉溶液、碘化钾淀粉试纸、过氧化氢溶液、稀硫酸。
①实验方法 。
②实验现象及结论: 。
(4)电解完毕,从电解液中得到碘酸钾晶体的实验过程如下
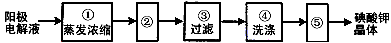
步骤②的操作名称是________________,步骤⑤的操作名称是___________。步骤④洗涤晶体的目的是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知:①Fe(s)+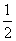 O2(g)=FeO(s) ΔH1=-272.0 kJ·mol-1;
O2(g)=FeO(s) ΔH1=-272.0 kJ·mol-1;
②2Al(s)+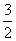 O2(g)===Al2O3(s) ΔH2=-1675.7 kJ·mol-1。
O2(g)===Al2O3(s) ΔH2=-1675.7 kJ·mol-1。
Al和FeO发生铝热反应的热化学方程式是 。
某同学认为,铝热反应可用于工业炼铁,你的判断是 (填“能”或“不能”),
你的理由是 。
(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,
如图所示。
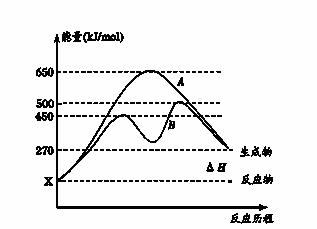
①据图判断该反应是___(填“吸”或“放”)热反应,当反应达到平衡后,其他
条件不变,升高温度,逆反应速率将____(填“增大”、“减小”或“不变”)。
②其中B历程表明此反应采用的条件为________(填字母)。
A.升高温度 B.增大反应物的浓度
C.降低温度 D.使用催化剂
(3)已知热化学方程式:H2(g)+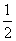 O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学活动课上,三组学生分别用图示甲、乙两装置,探究“NaHCO3和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查)。
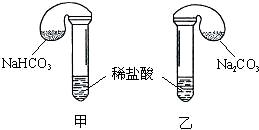
请回答:
(1)各组反应开始时,________装置中的气球体积先变大,该装置中反应的离子方程式是___________________________。
(2)当试管中不再有气体生成时,三组实验出现不同现象,填写下表的空格。
| 试剂用量 | 实验现象 (气球体积变化) | 分析原因 | |
| 第 ① 组 | 0.42 g NaHCO3 0.53 g Na2CO3 3 mL 4 mol/L盐酸 | 甲中气球与乙中气球的体积相等 | 甲、乙盐酸均过量 n(NaHCO3)=n(Na2CO3) V甲(CO2)=V乙(CO2) |
| 第 ② 组 | 0.3 g NaHCO3 0.3 g Na2CO3 3 mL 4 mol/L盐酸 | 甲中气球比乙中气球的体积大 | |
| 第 ③ 组 | 0.6 g NaHCO3 0.6 g Na2CO3 3 mL 2 mol/L盐酸 | 甲中气球比乙中气球的体积大 | |
| 片刻后,乙中气球又缩小,甲中气球的体积基本不变 | (用离子方程式表示) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com