
下列过程伴随的能量变化中,属于反应热的是( )
A.形成1 mol H—Cl键放出的能量
B.石墨转变成金刚石吸收的能量
C.1 mol O2形成2 mol O原子吸收的能量
D.水蒸气变成液态水放出的能量
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。在一定温度下,氧化铁可以与一氧化碳发生下列反应:
Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g)
(1)该温度下,在2 L盛有Fe2O3粉末的密闭容器中通入CO气体,10 min后,生成了单质铁11.2 g。则10 min内CO的平均反应速率为________。
(2)请用上述反应中某种气体的有关物理量来说明该反应已达到平衡状态:
①_____________________;
②_____________________。
(3)某些金属氧化物粉末和铝粉在镁条的引燃下可以发生铝热反应。下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是________。

(4)写出氢氧化铝在水中发生碱式电离的电离方程式:_____________________;
欲使上述体系中铝离子浓度增加,可加入的物质是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中加入A、B、C三种气体,保持一定温度,在t1~t4时刻测得各物质的浓度如下表。据此判断下列结论正确的是( )
| 测定时刻/s | t1 | t2 | t3 | t4 |
| c(A)/(mol·L-1) | 6 | 3 | 2 | 2 |
| c(B)/(mol·L-1) | 5 | 3.5 | 3 | 3 |
| c(C)/(mol·L-1) | 1 | 2.5 | 3 | 3 |
A.在t3时刻反应已经停止
B.A的转化率比B的转化率低
C.在容器中发生的反应为:2A+B2C
D.在t2~t3内A的平均反应速率为:
[1/(t3-t2)]mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
接触法制硫酸工艺中,其主反应在450 ℃并有催化剂存在下进行:
2SO2(g)+O2(g)2SO3(g) ΔH=-190 kJ/mol
(1)该反应所用的催化剂是________(填写化合物名称),该反应450 ℃时的平衡常数________500 ℃时的平衡常数(填“大于”、“小于”或“等于”)。
(2)该热化学反应方程式的意义是___________________________________
___________________________________________________________________。
(3)下列说法能表明反应已达平衡状态的是________。
a.v(O2)正=2v(SO3)逆
b.容器中气体的平均相对分子质量不随时间而变化
c.容器中气体的密度不随时间而变化
d.容器中气体的分子总数不随时间而变化
(4)在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3 0.18 mol,则v(O2)=________mol·(L·min)-1;若继续通入0.20 mol SO2和0.10 mol O2,则平衡________移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,________mol<n(SO3)<________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个不导热的恒容密闭容器中通入CO(g)和H2O(g),一定条件下使反应CO(g)+H2O(g)===CO2(g)+H2(g)达到平衡状态,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是( )
A.反应物浓度:a点小于c点
B.c点时反应进行的程度最大
C.该反应的正反应为吸热反应
D.Δt1=Δt2时,生成H2的物质的量:a~b段小于b~c段
查看答案和解析>>
科目:高中化学 来源: 题型:
有一种锂水电池,可作为鱼雷和潜艇的储备电源。电池以金属锂和钢板为电极材料,LiOH为电解质,使用时加入水即可放电。关于该电池的说法正确的是( )
A.钢板为正极,钢板上发生还原反应
B.放电时电子的流动方向是“正极→导线→负极”
C.放电过程中OH-向正极做定向移动
D.总反应:2Li+2H+==2Li++H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨反应为3H2+N2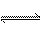 2NH3,其反应速率可以分别为v(H2)、v(N2)、v(NH3)[mol·(L·s)-1]表示,则正确的关系式为( )
2NH3,其反应速率可以分别为v(H2)、v(N2)、v(NH3)[mol·(L·s)-1]表示,则正确的关系式为( )
A.v(H2)=v(N2)=v(NH3) B.3v(H2)=v(N2)
C.v(NH3)=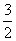 v(H2) D.v(H2)=3v(N2)
v(H2) D.v(H2)=3v(N2)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知难溶于水的盐在水中存在溶解平衡,例如氯化银在水中的溶解平衡为AgCl(s) Ag++Cl-
Ag++Cl-
在一定温度下,水溶液中银离子(Ag+)和氯离子(Cl-)的物质的量浓度的乘积为一常数,可用Ksp表示:Ksp=c(Ag+)·c(Cl-)=1.8×10-10
现把氯化银(足量)分别放入:①100 mL蒸馏水中;②100 mL0.1 mol/L盐酸溶液中;③1 000 mL0.1 mol/L的氯化铝溶液中;④100 mL 0.01 mol/L的氯化镁溶液中,充分搅拌后,相同温度下,银离子浓度由大到小的顺序是(用序号回答)________________________。
在0.1 mol/L氯化铝溶液中,银离子的物质的量浓度最大可达到__________mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com