
有一种锂水电池,可作为鱼雷和潜艇的储备电源。电池以金属锂和钢板为电极材料,LiOH为电解质,使用时加入水即可放电。关于该电池的说法正确的是( )
A.钢板为正极,钢板上发生还原反应
B.放电时电子的流动方向是“正极→导线→负极”
C.放电过程中OH-向正极做定向移动
D.总反应:2Li+2H+==2Li++H2↑
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列说法中正确的是 ( )
A.1L水中溶解了58.5 g NaCl,该溶液的物质的量浓度为1mol/L
B.从1L2mol/L的H2SO4溶液中取出0.5L,该溶液的浓度为1mol/L
C.配制500mL0.2mol/L的CuSO4溶液,需25g胆矾
D.中和100mL1mol/L的H2SO4溶液,需NaOH4g
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法正确的是( )
A.CaCO3(s)===CaO(s)+CO2(g)室温下不能自发进行,说明该反应的ΔH<0
B.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈
C.N2(g)+3H(g)===2NH3(g) ΔH<0,其他条件不变时升高温度,反应速率v(H2)和H2的平衡转化率均增大
D.水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列过程伴随的能量变化中,属于反应热的是( )
A.形成1 mol H—Cl键放出的能量
B.石墨转变成金刚石吸收的能量
C.1 mol O2形成2 mol O原子吸收的能量
D.水蒸气变成液态水放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2,下列对该溶液的叙述不正确的是( )
A.该温度高于25 ℃
B.由水电离出来的H+的浓度是1.0×10-12 mol·L-1
C.加入NaHSO4晶体抑制了水的电离
D.c(H+)=c(OH-)+c(SO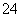 )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中可以证明反应H2(g)+I2(g)2HI(g)已达平衡状态的是______________。
①单位时间内生成n mol H2的同时生成n mol HI ②一个H—H键断裂的同时有两个H—I键断裂 ③百分含量w(HI)=w(I2) ④反应速率v(H2)=v(I2)=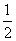 v(HI) ⑤c(HI):c(H2):c(I2)=2:1:1 ⑥温度和体积一定时,生成物浓度不再变化 ⑦温度和体积一定时,容器内的压强不再变化 ⑧条件一定时,混合气体的平均相对分子质量不再变化 ⑨温度和体积一定时,混合气体颜色不再变化 ⑩温度和压强一定时,混合气体的密度不再变化
v(HI) ⑤c(HI):c(H2):c(I2)=2:1:1 ⑥温度和体积一定时,生成物浓度不再变化 ⑦温度和体积一定时,容器内的压强不再变化 ⑧条件一定时,混合气体的平均相对分子质量不再变化 ⑨温度和体积一定时,混合气体颜色不再变化 ⑩温度和压强一定时,混合气体的密度不再变化
在上述⑥~⑩的说法中,能证明2NO2(g)N2O4(g)达到平衡状态的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
向四个体积相同的密闭容器(甲、乙、丙、丁)中分别充入一定量的SO2和O2,开始反应时,按反应速率由大到小排列顺序正确的是( )
甲:在500 ℃时,10 mol SO2和6 mol O2反应
乙:在500 ℃时,用V2O5作催化剂,10 mol SO2和5 mol O2反应
丙:在450 ℃时,8 mol SO2和5 mol O2反应
丁:在500 ℃时,8 mol SO2和5 mol O2反应
A.甲、乙、丙、丁 B.乙、甲、丙、丁
C.乙、甲、丁、丙 D.丁、丙、乙、甲
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式书写正确的是( )。
A.铝片放入氢氧化钠溶液中:Al+2OH-=AlO2-+H2↑
B.Na与水反应:Na+2H2O=Na++H2↑+2OH-
C.向AlCl3溶液中加入过量NaOH溶液:Al3++3OH-=Al(OH)3↓
D.AlCl3溶液中滴入过量的氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如图所示的变化规律(图中p表示压强,T表示温度,n表示物质的量,α表示物质的平衡转化率)。根据以上规律判断,下列结论中正确的是( )

A.反应Ⅰ:ΔH>0,p2>p1
B.反应Ⅱ:ΔH<0,T1>T2
C.反应Ⅰ:ΔH<0,p2>p1
D.反应Ⅱ:ΔH>0,T2>T1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com