
向四个体积相同的密闭容器(甲、乙、丙、丁)中分别充入一定量的SO2和O2,开始反应时,按反应速率由大到小排列顺序正确的是( )
甲:在500 ℃时,10 mol SO2和6 mol O2反应
乙:在500 ℃时,用V2O5作催化剂,10 mol SO2和5 mol O2反应
丙:在450 ℃时,8 mol SO2和5 mol O2反应
丁:在500 ℃时,8 mol SO2和5 mol O2反应
A.甲、乙、丙、丁 B.乙、甲、丙、丁
C.乙、甲、丁、丙 D.丁、丙、乙、甲
科目:高中化学 来源: 题型:
已知一定温度和压强下,合成氨反应:N2(g)+3H2(g)===2NH3(g) ΔH=-92.0 kJ·mol-1,将1 mol N2和3 mol H2充入一密闭容器中,保持恒温恒压,在催化剂存在时进行反应,达到平衡时,测得N2的转化率为20%。若在相同条件下,起始时向该容器中充入2 mol NH3,反应达到平衡时的热量变化是( )
A.吸收18.4 kJ热量 B.吸收73.6 kJ热量
C.放出18.4 kJ热量 D.放出73.6 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
接触法制硫酸工艺中,其主反应在450 ℃并有催化剂存在下进行:
2SO2(g)+O2(g)2SO3(g) ΔH=-190 kJ/mol
(1)该反应所用的催化剂是________(填写化合物名称),该反应450 ℃时的平衡常数________500 ℃时的平衡常数(填“大于”、“小于”或“等于”)。
(2)该热化学反应方程式的意义是___________________________________
___________________________________________________________________。
(3)下列说法能表明反应已达平衡状态的是________。
a.v(O2)正=2v(SO3)逆
b.容器中气体的平均相对分子质量不随时间而变化
c.容器中气体的密度不随时间而变化
d.容器中气体的分子总数不随时间而变化
(4)在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3 0.18 mol,则v(O2)=________mol·(L·min)-1;若继续通入0.20 mol SO2和0.10 mol O2,则平衡________移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,________mol<n(SO3)<________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
有一种锂水电池,可作为鱼雷和潜艇的储备电源。电池以金属锂和钢板为电极材料,LiOH为电解质,使用时加入水即可放电。关于该电池的说法正确的是( )
A.钢板为正极,钢板上发生还原反应
B.放电时电子的流动方向是“正极→导线→负极”
C.放电过程中OH-向正极做定向移动
D.总反应:2Li+2H+==2Li++H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱。25 ℃时,有关物质的电离平衡常数如下表所示:
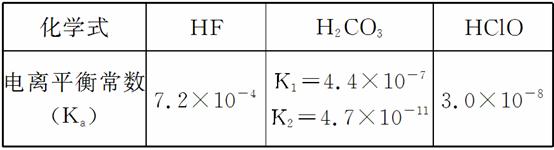
(1)将浓度为0.1 mol·L-1 HF溶液加水稀释一倍(假设温度不变),下列各量增大的是________。
A.c(H+) B.c(H+)·c(OH-)
C.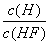 D.
D.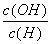
(2)25 ℃时,在20 mL 0.1 mol·L-1氢氟酸中加入V mL 0.1 mol·L-1 NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是________。
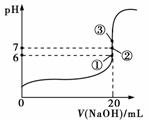
A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中c(F-)-c(Na+)=9.9×10-7 mol·L-1
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20 mL,此时溶液中c(F-)<c(Na+)=0.1 mol·L-1
(3)物质的量浓度均为0.1 mol·L-1的下列四种溶液:①Na2CO3溶液;②NaHCO3溶液;③NaF溶液;④NaClO溶液。依据数据判断pH由大到小的顺序是__________________。
(4)Na2CO3溶液显碱性是因为CO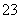 水解的缘故,请设计简单的实验事实证明之__________________。
水解的缘故,请设计简单的实验事实证明之__________________。
(5)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H—O—F。HFO与水反应得到HF和化合物A,每生成1 mol HF转移________mol电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨反应为3H2+N2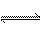 2NH3,其反应速率可以分别为v(H2)、v(N2)、v(NH3)[mol·(L·s)-1]表示,则正确的关系式为( )
2NH3,其反应速率可以分别为v(H2)、v(N2)、v(NH3)[mol·(L·s)-1]表示,则正确的关系式为( )
A.v(H2)=v(N2)=v(NH3) B.3v(H2)=v(N2)
C.v(NH3)=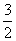 v(H2) D.v(H2)=3v(N2)
v(H2) D.v(H2)=3v(N2)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于反应能量的说法正确的是( )
A.Zn(s)+CuSO4(aq)===ZnSO4(aq)+Cu(s)
ΔH=-216 kJ/mol,反应物总能量>生成物总能量
B.CaCO3(s)===CaO(s)+CO2(g) ΔH=+178.5 kJ/mol,反应物总能量>生成物总能量
C.101kPa时,2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ/mol,H2的燃烧热为571.6 kJ/mol
D.H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ/mol,含1 molNaOH的氢氧化钠溶液与含0.5 mol H2SO4的浓硫酸混合后放出57.3 kJ的热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com