

| Al(OH)3 | Fe(OH)3 | |
| 开始沉淀的PH | 3.1 | 2.3 |
| 沉淀完全的 PH | 5.3 | 3.7 |
| 3.76g |
| 4.00g |


科目:高中化学 来源: 题型:
| A、2.8g | B、5.6g |
| C、11.2g | D、1.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:
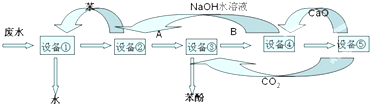
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙酸分子中含有碳氧双键,所以乙酸能使酸性高锰酸钾溶液褪色 |
| B、乙酸俗称醋酸,无水乙酸又称为冰醋酸,它是纯净物 |
| C、乙酸是重要的有机酸,是一种有刺激性气味的液体 |
| D、可以用乙酸除去热水瓶中的水垢 |
查看答案和解析>>
科目:高中化学 来源: 题型:
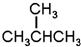 G.
G.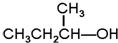 和
和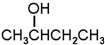
| 类型 | 同系物 | 同分异构体 | 同位素 | 同素异形体 |
| 组号 |
查看答案和解析>>
科目:高中化学 来源: 题型:
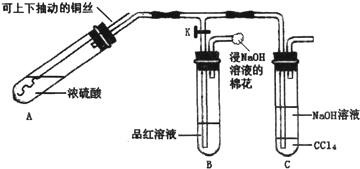
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡向逆反应方向移动 |
| B、a+b>c+d |
| C、Z的体积分数减少 |
| D、X的转化率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com