
【题目】如图,四种装置中所盛的溶液体积均为500mL,浓度均为0.6molL-1,(③可以实现铁表面镀锌)工作一段时间后,测得导线上均通过了0.2mol电子,此时溶液中的pH由大到小的顺序是
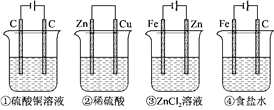
A. ④②①③
B. ④③①②
C. ④③②①
D. ①③②④
科目:高中化学 来源: 题型:
【题目】化学与人类生活、生产、环境密切相关,下列说法不正确的是
A. 干燥剂硅胶、硅橡胶和光导纤维的主要成分都是二氧化硅
B. 把石灰浆喷涂在树干上可消灭树皮上的过冬虫卵
C. 防伪荧光油墨由颜料与树脂连接料等制成,其中树脂属于有机高分子材料
D. 新能源汽车的推广使用有助于减少光化学烟雾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是
A. 己知2H2(g)+O2(g)=2H2O(g) △H=-483.6 kJ/mol,则H2的标准燃烧热为-241.8 kJ/mol
B. 已知C(石墨,s)==C(金刚石,s) △H>0,则金刚石比石墨稳定
C. 含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热置,则该反应的热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.4kJ/mol
D. 已知 2SO2(g)+O2(g) ![]() 2SO3(g) △H=-QkJ·mol-1(Q>0),则将2mol SO2(g)和lOmol O2(g)置于一密闭容器中充分反应后放出QkJ的热量
2SO3(g) △H=-QkJ·mol-1(Q>0),则将2mol SO2(g)和lOmol O2(g)置于一密闭容器中充分反应后放出QkJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、依据事实,写出下列反应的热化学方程式。
(1)在25 ℃、101 kPa下,1 g甲烷燃烧生成CO2和液态水时放热55.625 kJ。则表示甲烷燃烧热的热化学方程式为________________________。
(2)若适量的N2和O2完全反应,每生成23 g NO2需要吸收16.95 kJ热量,则表示该反应的热化学方程式为______________。
(3)在25 ℃、101 kPa条件下,C(s)、H2(g)、CH3COOH(1)的燃烧热分别为393.5 kJ/mol、285.8 kJ/mol、870.3 kJ/mol,则2C(s)+2H2(g)+O2(g)===CH3COOH(1)的反应热ΔH为________。
II、锌锰干电池是应用最普遍的电池之一。其基本反应为:
X极:Zn-2e-===Zn2+
Y极:2MnO2+2NH![]() +2e-===Mn2O3+2NH3+H2O
+2e-===Mn2O3+2NH3+H2O
(1)X是电池的________(填“正”或“负”,下同)极,Y是电池的________极。
(2)该电池总反应的离子方程式为:_______________________。
(3)若反应消耗16.25gZn,则电池中转移电子的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,4-二苯基丁烷是用来研究聚合物溶剂体系热力学性质的重要物质,工业上用下列方法制备1, 4-二苯基丁烷。(格拉泽反应:2R-C≡C-H![]() R-C≡C-C≡C-R+H2)
R-C≡C-C≡C-R+H2)

回答下列问题:
(1)②和⑤的反应类型分别为__________________、____________。
(2)反应③由C生成D的条件是_____________________。
(3)E的结构简式为___________,该分子中位于同一直线上的原子最多是___________个。
(4)反应①的化学方程式是___________。
(5)C与足量氢氧化钠水溶液反应可制得化合物F,F的分子式是__________,同时符合下列条件的F的同分异构体有_____________种(不含立体异构)。
①1mol该异构体最多能与2mol NaOH溶液反应
②该异构体的核磁共振氢谱显示为3组峰,且峰面枳之比为1:1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。下列说法错误的是
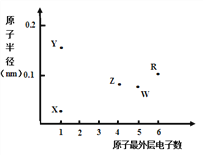
A. 简单离子半径:Y < W
B. 最高价氧化物对应水化物的酸性:Z < W
C. R为氧元素
D. X与Z可以形成正四面体结构的分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,世界上生产的镁有60%来自海水,其生产流程图如下

(1)贝壳的主要化学成分为______(写化学式);
(2)写出反应②的离子方程式:__________________________________________。
(3)根据流程图可知 可循环利用的物质是______________________________。
(4)Mg与CO2反应时,有白色粉末并有黑色固体生成。请写出Mg与CO2反应的化学方程式并标出电子转移的方向与数目:____________________________________________________。
(5)Na比Mg和Al要活泼,将Na投入到 Fe2(SO4)3溶液中会发生剧烈的化学反应,其离子方程式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯酚是一种重要的化工原料,以苯酚为主要起始原料,经下列反应可制得香料M和高分子化合物N。(部分产物及反应条件已略去)
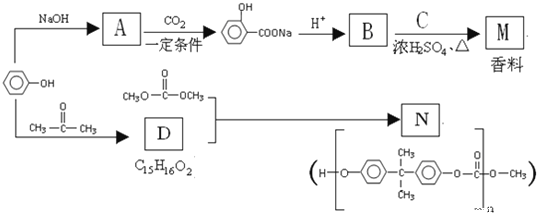
(1)有机物B的名称是_________。
(2)已知C的分子式为C5H12O,C能与金属Na反应,C的一氯代物有2种.C的结构简式是___________.
(3)B与C反应的反应类型是________由D生成N的反应类型是________。
(4)由苯酚生成D的化学方程式是_____________。
(5)F是分子量比B大14的同系物,则F的分子式是_________,F有多种同分异构体,符合下列条件的同分异构体有_____种。
①属于芳香族化合物;
②遇FeCl3溶液显紫色,且能发生水解反应;
③苯环上有两个取代基,且苯环上的一溴代物只有两种。
(6)已知: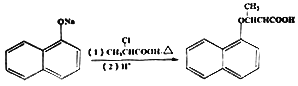 ,写出以苯酚、乙醇和CH2ClCOOH为原料制备
,写出以苯酚、乙醇和CH2ClCOOH为原料制备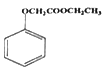 的合成路线流程图(无机试剂任用)。_____
的合成路线流程图(无机试剂任用)。_____
合成路线流程图示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3经一系列反应可以得到HNO3,如下图所示。

(1)I中,NH3和O2在催化剂作用下反应,其化学方程式是____________。
(2)II中,2NO(g)+O2(g)![]() 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如下图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如下图)。

①比较P1、P2的大小关系:P1______P2(用“>”、“<”、“=”)
②随温度升高,该反应平衡常数变化的趋势是________。
(3)III中,将NO2、O2、H2O化合制硝酸的化学方程式_______。
(4)IV中,电解NO制备 NH4NO3,其工作原理如下图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是_____________,说明理由:________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com