
【题目】目前,世界上生产的镁有60%来自海水,其生产流程图如下

(1)贝壳的主要化学成分为______(写化学式);
(2)写出反应②的离子方程式:__________________________________________。
(3)根据流程图可知 可循环利用的物质是______________________________。
(4)Mg与CO2反应时,有白色粉末并有黑色固体生成。请写出Mg与CO2反应的化学方程式并标出电子转移的方向与数目:____________________________________________________。
(5)Na比Mg和Al要活泼,将Na投入到 Fe2(SO4)3溶液中会发生剧烈的化学反应,其离子方程式为____________________________________。
【答案】 CaCO3 Mg(OH)2+2H+=Mg2++2H2O 盐酸或者氯气 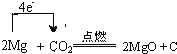 6Na+6H2O+2Fe3+=2Fe(OH)3↓+6Na++3H2↑
6Na+6H2O+2Fe3+=2Fe(OH)3↓+6Na++3H2↑
【解析】(1)贝壳的主要化学成分为碳酸钙,化学式为CaCO3;(2)反应②是盐酸溶解氢氧化镁,反应的离子方程式为Mg(OH)2+2H+=Mg2++2H2O。(3)根据流程图可知可循环利用的物质是氯气;(4)Mg与CO2反应时,有白色粉末并有黑色固体生成,这说明生成物是氧化镁和碳,因此出Mg与CO2反应的化学方程式以及电子转移的方向与数目可表示为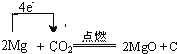 。(5)将Na投入到 Fe2(SO4)3溶液中首先钠与水反应生成氢氧化钠和氢气,然后氢氧化钠和硫酸铁反应,所以离子方程式为6Na+6H2O+2Fe3+=2Fe(OH)3↓+6Na++3H2↑。
。(5)将Na投入到 Fe2(SO4)3溶液中首先钠与水反应生成氢氧化钠和氢气,然后氢氧化钠和硫酸铁反应,所以离子方程式为6Na+6H2O+2Fe3+=2Fe(OH)3↓+6Na++3H2↑。


科目:高中化学 来源: 题型:
【题目】下列叙述中,不能用勒夏特列原理解释的是( )
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 高压比常压有利于合成SO3
C. 加入催化剂有利于氨的合成
D. 工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸锰(MnCO3)是制造电信器材的软磁铁氧体,也用作脱硫的催化剂,瓷釉、涂料和清漆的颜料。工业上利用软锰矿(主要成分是MnO2,还含有Fe2O3、CaCO3、CuO等杂质)制取碳酸锰的流程如下图所示:

已知:还原焙烧主反应为:2MnO2+C![]() 2MnO+CO2↑。
2MnO+CO2↑。
可能用到的数据如下:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Mn(OH)2 |
开始沉淀pH | 1.5 | 6.5 | 4.2 | 8.3 |
沉淀完全pH | 3.7 | 9.7 | 7.4 | 9.8 |
根据要求回答下列问题:
(1)在实验室进行步骤A,需要用到的仪器为________________,步骤B中若采用质量分数为35%的硫酸(密度ρ=1.26 g/cm3),则其物质的量浓度为_________。
(2)步骤C中得到的滤渣主要成分是_______________,步骤D中还原剂与氧化剂的物质的量之比为__________。
(3)步骤E中调节pH的范围为________,其目的是_____________________________。
(4)步骤G的离子方程式为___________________,若Mn2+沉淀完全时测得溶液中CO32-的浓度为2.2×10-6 mol/L,则Ksp(MnCO3)=__________。
(5)实验室可以用Na2S2O8溶液来检验Mn2+是否完全发生反应,原理为:
Mn2++S2O82-+H2O=H++SO42-+MnO4-,
①请配平上述离子方程式____________________________;
②确认Mn2+离子已经完全反应的现象是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,四种装置中所盛的溶液体积均为500mL,浓度均为0.6molL-1,(③可以实现铁表面镀锌)工作一段时间后,测得导线上均通过了0.2mol电子,此时溶液中的pH由大到小的顺序是
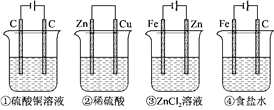
A. ④②①③
B. ④③①②
C. ④③②①
D. ①③②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知4NH3+ 5O2==4NO + 6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,正确的关系是( )
A. 4v(NH3)=5v(O2) B. 6v(O2)= 5v(H2O) C. 6v(NH3)=4v(H2O) D. 5v(O2)= 4v(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从薄荷中提取的薄荷醇可制成医药。薄荷醇的结构简式如下图,下列说法正确的是
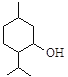
A. 薄荷醇分子式为C10H20O,它是环己醇的同系物
B. 薄荷醇的分子中至少有12个原子处于同一平面上
C. 薄荷醇在Cu或Ag做催化剂、加热条件下能被O2氧化为醛
D. 在一定条件下,薄荷醇能发生取代反应、消去反应和聚合反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醛酸(OHC-COOH)是合成名贵香料的原料之一。
I.由乙二醛催化氧化制乙醛酸的反应如下:2OHC-CHO(g)+O2(g) ![]() 2OHC-COOH(g)△H
2OHC-COOH(g)△H
(1)已知反应中相关的化学键键能数据如表1:
化学键 | O=O | C-O | O-H | C-H |
键能(KJ/mol) | 498 | 351 | 465 | 413 |
计算上述反应的△H=____________kJ·mol-1。
(2)一定条件下,按照![]() 投料比进行上述反应,乙二醛的平衡转化率(a)和催化剂催化效率随温度变化如图所示。
投料比进行上述反应,乙二醛的平衡转化率(a)和催化剂催化效率随温度变化如图所示。

①该反应在A点放出的热量________B点放出的热量(填“>”、“=”或“<”)
②某同学据图推知,生成乙醛酸的速率:v(A)>v(B),你认为此结论是否正确,简述理由__________。
③图中A点时,乙醛酸的体积分数为_____________。
④为提高乙二醛的平衡转化率,除改变投料比、温度外,还可以采取的措施有__________ (列举一条)。
Ⅱ.利用惰性电极电解饱和乙二酸和稀硫酸溶液也可以制备乙醛酸,原理如图所示。
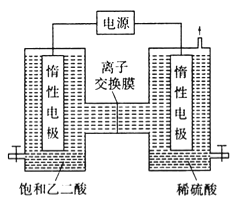
(1)图中的离子交换膜为___________ (填“阳”或“阴”)膜。
(2)稀硫酸的作用为____________。
(3)生成乙醛酸的电极反应式为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com